Charakterystyka cech siłowo-szybkościowych wybranych grup mięśniowych u mężczyzn w różnym wieku a poziom wydolności anaerobowej-fosfagenowej
Spis treści
- Wykaz skrótów stosowanych w pracy
- 1. WSTĘP
- 1.1 ZMIANY ZACHODZĄCE W SKŁADZIE CIAŁA Z WIEKIEM
- 1.2. ZMIANY ZACHODZĄCE Z WIEKIEM W SKŁADZIE RÓŻNYCH TYPÓW WŁÓKIEN MIĘŚNIOWYCH
- 1.3. MECHANIZMY ODPOWIEDZIALNE ZA GENEROWANIE SIŁY MIĘŚNIOWEJ
- 1.4. MECHANIZM POWSTAWANIA RELAKSACJI
- 1.5. CHARAKTERYSTYKA PRZEBIEGU RELAKSACJI
- 1.6. ZMIANY SIŁY MIĘŚNIOWEJ Z WIEKIEM
- 1.7. OCENA SZYBKOŚCI NARASTANIA SIŁY I RELAKSACJI
- 1.8. ZMIANY W PRZEBIEGU NARASTANIA SIŁY I RELAKSACJI ZACHODZĄCE Z WIEKIEM
- 1.9. DŁUGOŚĆ MIĘŚNIA A SZYBKOŚĆ NARASTANIA SIŁY I RELAKSACJI U OSÓB W RÓŻNYM WIEKU
- 1.10. CHARAKTERYSTYKA MIĘŚNI O WYSOKIM LUB NISKIM MAKSYMALNYM GRADIENCIE NARASTANIA SIŁY
- 1.11. MOC MIĘŚNIOWA I ZMIANY JEJ POZIOMU, ZACHODZĄCE Z WIEKIEM
- 1.12. CELE PRACY
- 1.13. GŁÓWNE HIPOTEZY BADAWCZE
- 2. OSOBY BADANE
- 3. METODYKA BADAŃ
- 4. WYNIKI
- 4.1. Seria I: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
- 4.2. Seria II: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
- 4.3. Seria III: Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
- 5. DYSKUSJA
- 5.1. Seria I: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
- 5.1.1. WPŁYW ZMIAN KĄTA STAWOWEGO NA SIŁĘ MIĘŚNI
- 5.1.2. WPŁYW WIEKU NA PRZEBIEG NARASTANIA SIŁY W RÓŻNYCH KĄTACH
- 5.1.3. ZMIANY MVC ZACHODZĄCE Z WIEKIEM
- 5.1.4. CHARAKTERYSTYKA PRZEBIEGU RELAKSACJI
- 5.1.5. WPŁYW WIEKU NA PRZEBIEG RELAKSACJI
- 5.1.6. WPŁYW DŁUGOŚCI MIĘŚNI NA PRZEBIEG RELAKSACJI U OSÓB W RÓŻNYM WIEKU
- 5.2. Seria II: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
- 5.3. Seria III: Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
- 6. WNIOSKI
- PIŚMIENNICTWO
- SUMMARY
Spis rysunków
- 3.1. Stanowisko do badań siły mięśni stawu łokciowego, w warunkach izometrycznych "Biodyna". Objaśnienia w tekście - podrozdział 3.1.1.
- 3.2. Schematyczne przedstawienie pozycji badanego podczas pomiaru maksymalnej siły izometrycznej mięśni zginaczy stawu łokciowego, w płaszczyźnie poziomej, w trzech kątach stawowych: 60o, 90o i 120o
- 3.3. Stanowisko do badania siły mięśni zginaczy stawu łokciowego ("Biodyna"): 1 - faza reakcji początkowej; 2 - faza wczesnego narastania; 3 - faza połowy narastania; 4 - faza późnego narastania; 5 - faza końcowego narastania; 6 - faza reakcji końcowej; 7 - faza wczesnej relaksacji; 8 - faza połowy relaksacji; 9 - faza późnej relaksacji; 10 - faza końcowej relaksacji; SP - sygnał początkowy; SK - sygnał końcowy; MVC - maksymalna dowolna siła izometryczna; PtN - połowa czasu narastania siły; PtR - połowa czasu relaksacji
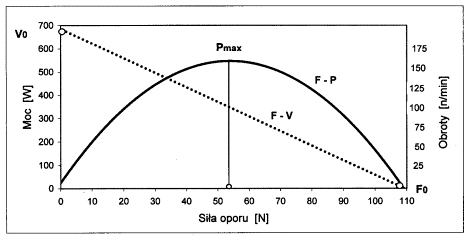
- 3.4. Zależność pomiędzy siłą oporu (F) a rozwijaną mocą (P) oraz pomiędzy siłą oporu a częstotliwością obrotów (V), w teście Vandewalle i wsp. Oznaczenia: Pmax - maksymalna moc fosfagenowa; V0 - graniczna liczba obrotów; F0 - graniczna wartość siły oporu.
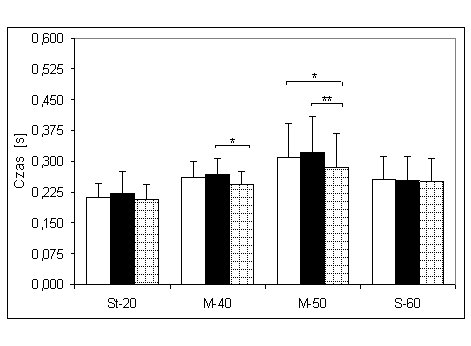
- 4.1. Wartości maksymalnej, dowolnej siły izometrycznej zginaczy stawu łokciowego oraz różnice pomiędzy trzema kątami pomiarowymi, w badanych grupach
- 4.2. Wartości maksymalnej, dowolnej siły izometrycznej wyrażanej na cm obwodu ramienia oraz różnice pomiędzy trzema kątami pomiarowymi w badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.3. Zależność pomiędzy MVC (średnia z trzech kątów) a wiekiem badanych mężczyzn *: zależność istotna na poziomie p<0,05
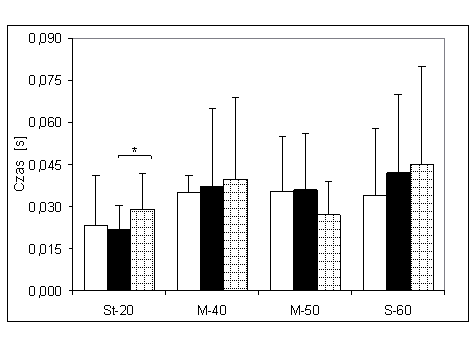
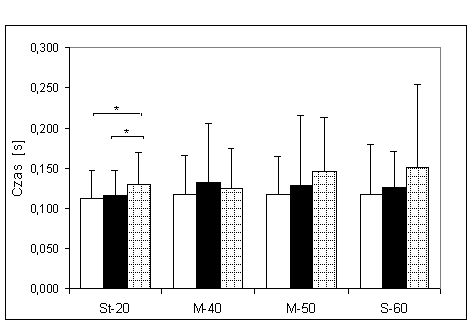
- 4.4. Czas osiągania MVC (tMVC) oraz istotność różnic pomiędzy trzema kątami pomiarowymi, w badanych grupach. Oznaczenia jak na ryc. 4.1.
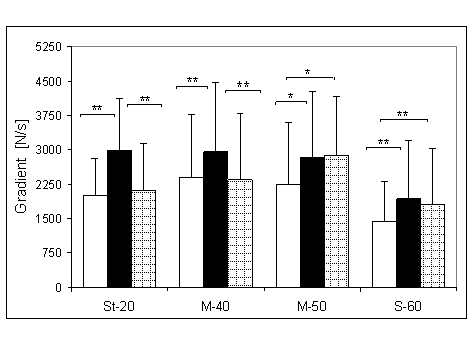
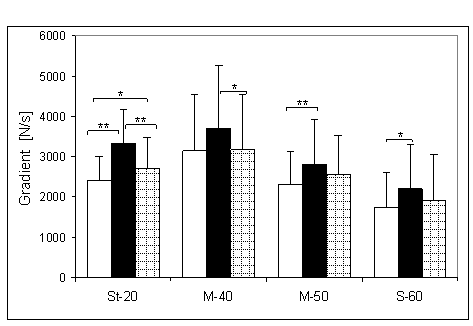
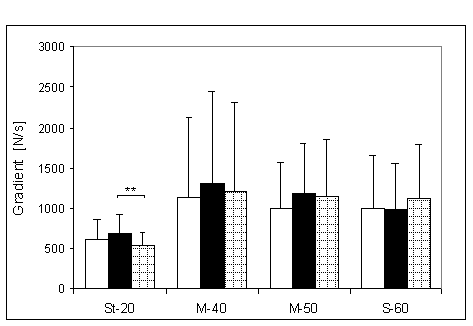
- 4.5. Maksymalny gradient narastania (MGN) oraz istotność różnic między kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
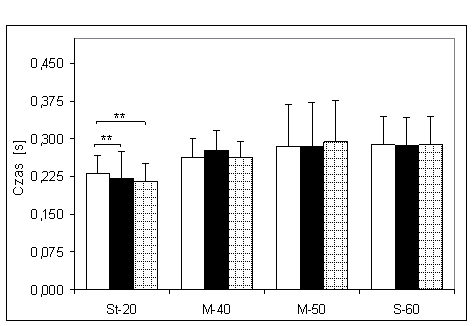
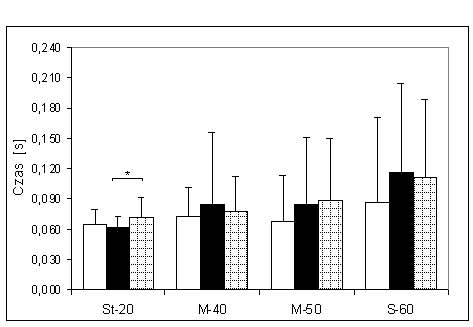
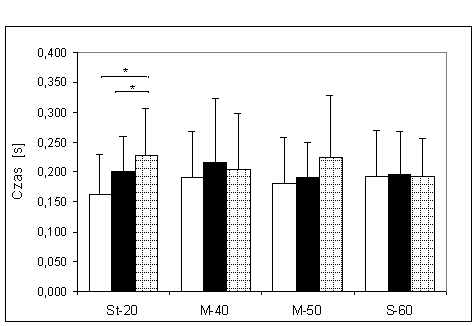
- 4.6. Czas osiągania MGN (tMGN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
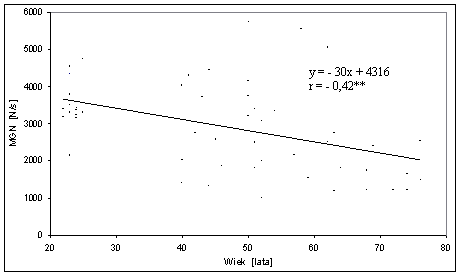
- 4.7. Zależność pomiędzy MGN (średnia z trzech kątów) a wiekiem badanych mężczyzn
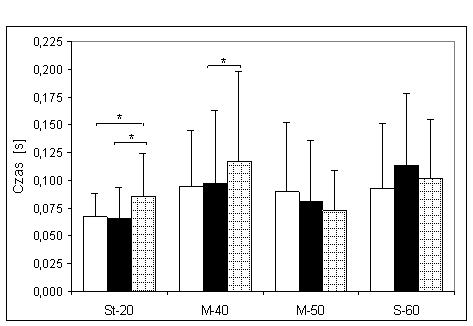
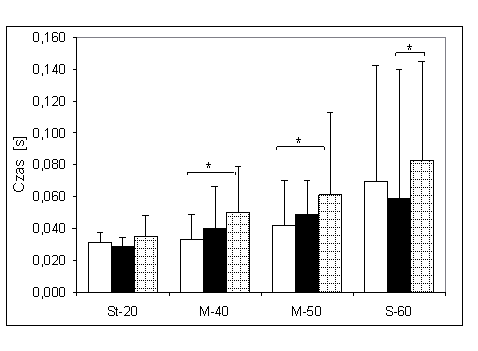
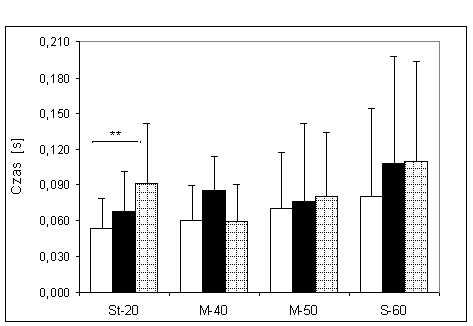
- 4.8. Czas reakcji początkowej oraz istotność różnic pomiędzy kątami pomiarowymi, w badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.9. Wartości gradientu wczesnego narastania (GWN) oraz istotność różnic pomiędzy trzema kątami pomiarowymi w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.10. Czas wczesnego narastania (tWN) oraz istotność różnic pomiędzy trzema kątami pomiarowymi w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.11. Gradient połowy narastania (G50%N) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.12. Połowa czasu narastania (PtN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.13. Gradient późnego narastania (GPN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.14. Czas późnego narastania (tPN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.15. Gradient końcowego narastania (GKN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.16. Czas końcowego narastania (tKN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
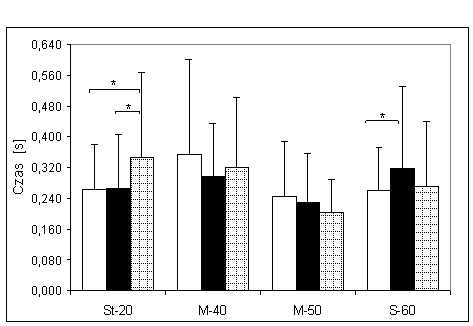
- 4.17. Czas reakcji końcowej (tRK) oraz istotność różnic pomiędzy kątami pomiarowymi, w badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.18. Gradient wczesnej relaksacji (GWR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.19. Czas wczesnej relaksacji (tWR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.20. Gradient połowy relaksacji (G50%R) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
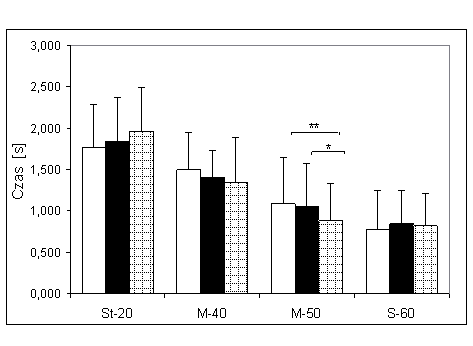
- 4.21. Połowa czasu relaksacji (PtR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.22. Gradient późnej relaksacji (GPR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.23. Czas późnej relaksacji (tPR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.24. Gradient końcowej relaksacji (GKR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.25. Czas końcowej relaksacji (tKR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
- 4.26. Maksymalny gradient relaksacji (MGR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
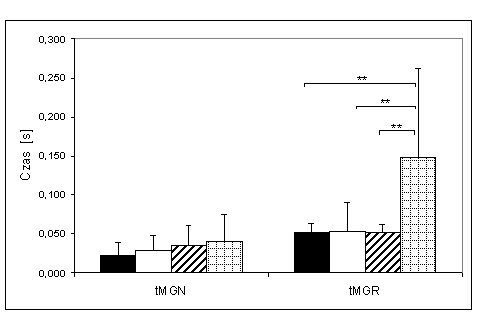
- 4.27. Czas osiągania MGR (tMGR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
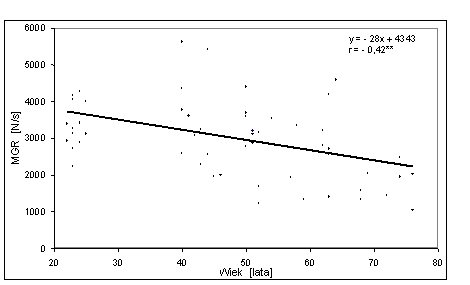
- 4.28. Zależność między MGR (średnia z trzech kątów) a wiekiem badanych mężczyzn
- 4.29. Maksymalny gradient narastania (MGN) oraz relaksacji (MGR) w grupach "szybkich" i "wolnych"
- 4.30. Czas osiągania MGN (tMGN) oraz MGR (tMGR) w grupach "szybkich" i "wolnych"
- 4.31. Gradient wczesnego narastania (GWN), połowy narastania (G50%N) oraz późnego narastania (GPN) w grupach "szybkich" (młodszej i starszej) i "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
- 4.32. Gradient końcowego narastania (GKN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
- 4.33. Czas fazy wczesnego narastania (tWN), połowy narastania (PtN) i późnego narastania (tPN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
- 4.34. Czas fazy końcowego narastania (tKN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
- 4.35. Gradient wczesnej relaksacji (GWR), połowy relaksacji (G50%R), późnej relaksacji (GPR) oraz końcowej relaksacji (GKR) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
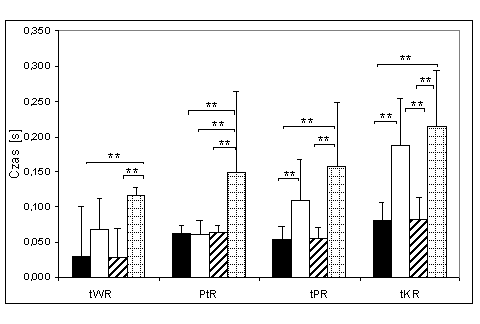
- 4.36. Czas trwania faz: wczesnej relaksacji (tWR), połowy relaksacji (PtR), późnej relaksacji (tPR) oraz końcowej relaksacji (tKR) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
- 4.37. Maksymalna moc (W) osiągana w teście mocy fosfagenowej oraz istotność różnic pomiędzy poszczególnymi grupami badanych
- 4.38. Maksymalna moc względna (W/kg masy ciała) osiągana w teście mocy fosfagenowej oraz istotności różnic pomiędzy poszczególnymi grupami badanych. Oznaczenia jak na ryc. 4.37.
- 4.39. Charakterystyka zależności między siłą oporu a częstotliwością obrotów w czterech grupach badanych mężczyzn, w próbie ergometrycznej Vandewalle i wsp.
- 4.40. Graniczna liczba obrotów (V0) w czterech badanych grupach oraz istotność różnic między nimi. Oznaczenia p<0,05; Inne: jak na ryc. 4.37.
- 4.41. Graniczna siła oporu (F0) w teście mocy fosfagenowej w czterech badanych grupach oraz istotność różnic między nimi. Oznaczenia: jak na ryc. 4.37.
- 4.42. Zależność pomiędzy mocą maksymalną (Pmax) testu wydolności fosfagenowej a wiekiem badanych z grup: St-20, M-40, M-50 i S-60;
- 4.43. Zależność pomiędzy względną mocą maksymalną (Pmax/kg) w teście wydolności fosfagenowej a wiekiem badanych z grup: St-20, M-40, M-50 i S-60;
- 4.44. Zależność pomiędzy graniczną liczbą obrotów w teście wydolności fosfagenowej a wiekiem badanych z grup: S-20, M-40, M-50 i S-60;
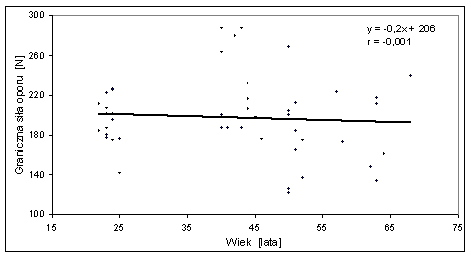
- 4.45. Zależność pomiędzy graniczną siłą oporu w teście wydolności fosfagenowej a wiekiem badanych z grup: S-20, M-40, M-50 i S-60; zależność statystycznie nieistotna
Spis tabel
- 2.1. Parametry biometryczne mężczyzn z czterech grup wiekowych: St-20 (n = 15), M-40 (n = 16), M-50 (n = 16) oraz S-60 (n = 16), w I. serii badań
- 2.2. Charakterystyka biometryczna mężczyzn z czterech grup: Sz-Mł (n=15), Sz-St (n=10), W-Mł (n=15) oraz W-St (n=10), w II. serii badańPo tak dokonanym podziale na grupy "szybkie" i "wolne" dokonano analizy statystycznej uzyskanych wyników. Oceniano różnice oraz ich istotność, pomiędzy osobnikami "szybkimi" a "wolnymi" w różnych grupach wiekowych oraz różnice pomiędzy "szybkimi" a "wolnymi" w tych samych grupach wiekowych. Rozpatrywano różnice w zakresie poziomu osiąganych gradientów oraz czasów poszczególnych faz narastania siły pomiędzy odpowiednimi grupami badanych. Podobnie postępowano pod względem gradientów oraz czasów relaksacji.
- 2.3. Charakterystyka biometryczna mężczyzn z czterech grup wiekowych: St-20 (n = 25), M-40 (n = 14), M-50 (n = 15) oraz S-60 (n = 8), w teście mocy fosfagenowej
- 4.1. Wartości wewnątrzklasowego współczynnika korelacji (ICC), dla parametrów fazy narastania siły i relaksacji, dla wszystkich badanych
- 4.2. Maksymalna dowolna siła izometryczna (MVC), maksymalny gradient narastania siły (MGN), maksymalny gradient relaksacji (MGR) i czasy ich osiągania, w kącie 60o (A), 90o (B) oraz 120o (C), w czterech badanych grupach wiekowych
- 4.3. Istotne różnice MVC i gradientów (A) w kątach 60o, 90o lub 120o oraz czasu trwania (B) poszczególnych faz narastania siły i relaksacji, pomiędzy badanymi grupami
- 4.4. Parametry narastania siły w kącie 60o (A), 90o (B) i 120o (C), w czterech grupach wiekowych mężczyzn
- 4.5. Istotne statystycznie współczynniki korelacji pomiędzy wiekiem badanych a gradientami i czasami narastania siły oraz relaksacji (średnia z trzech kątów: 60o, 90o i 120o) kolejnych faz
- 4.6. Parametry relaksacji w kącie 60o (A), 90o (B) i 120o (C), w czterech grupach wiekowych mężczyzn
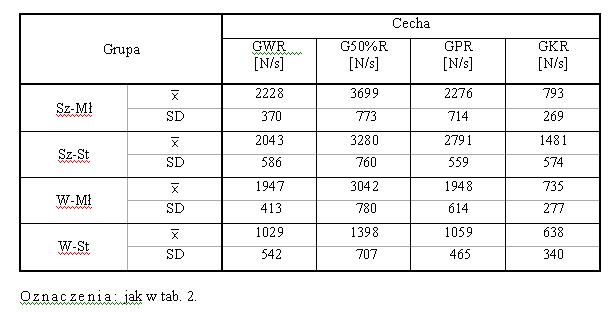
- 4.7. Maksymalne wartości dowolnej siły izometrycznej [N] oraz gradientów narastania i relaksacji [N/s] oraz czasu ich osiągania [s], w grupach "wolnych" i "szybkich"
- 4.8. Gradienty kolejnych faz narastania siły, wyrażone w [N/s]
- 4.9. Czas trwania kolejnych faz narastania siły, wyrażony w [s]
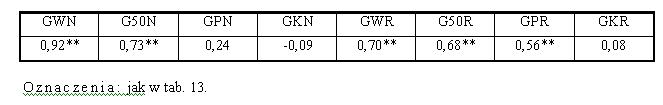
- 4.10. Korelacje pomiędzy MGN a gradientami narastania (A) oraz relaksacji (B), w grupach "szybkich" i "wolnych"
- 4.11. Korelacje pomiędzy MGN a gradientami narastania i relaksacji dla "szybkich" (młodszych i starszych)
- 4.12. Korelacje pomiędzy MGN a gradientami narastania i relaksacji dla "wolnych" (młodszych i starszych)
- 4.13. Gradienty kolejnych faz relaksacji, wyrażone w [N/s]
- 4.14. Czas trwania kolejnych faz relaksacji, wyrażony w [s]
- 4.15. Parametry testu wydolności fosfagenowej mężczyzn z czterech grup: St-20 (n = 25), M-40 (n = 15), M-50 (n = 14) i S-60 (n = 8)
- 4.16. Wartości współczynników korelacji pomiędzy maksymalną mocą fosfagenową (Pmax) a składową siłową (F0) oraz składową szybkościową (V0) dla wszystkich badanych oraz dla każdej z grup
ATP - adenozyno-3-fosforan
ADP - adenozyno-2-fosforan
AMP - adenozyno-1-fosforan
Ä - Ängström
Ca-ATP-aza - enzym (ATP-aza) aktywowany przez jony wapnia
CSA - pole przekroju poprzecznego mięśnia
F - siła oporu przyłożona do koła zamachowego ergometru
FM - całkowita masa tkanki tłuszczowej w organizmie
FT - włókna mięśniowe szybko kurczące się
FTb - włókna mięśniowe szybko kurczące się o zwiększonym potencjale glikolitycznym
F0 - graniczna wartość siły oporu, przy której badany nie byłby już w stanie wykonać żadnego obrotu pedałami ergometru
GKN - gradient końcowego narastania siły
GKR - gradient końcowej relaksacji
GPN - gradient późnego narastania siły
GPR - gradient późnej relaksacji
GWN - gradient wczesnego narastania siły
GWR - gradient wczesnej relaksacji
G50%N - gradient połowy narastania siły
G50%R - gradient połowy relaksacji
ICC - wewnątrzklasowy współczynnik korelacji
LBM - masa tkanki beztłuszczowej w organizmie
LMV - objętość tkanki beztłuszczowej
Lo - długość mięśnia (optymalna), przy której uzyskiwana jest największa siła mięśnia
MGN - maksymalny gradient narastania siły
MGR - maksymalny gradient relaksacji
MK - miokinaza
MVC - maksymalna dowolna siła izometryczna
M-40 - grupa mężczyzn w wieku od 34 do 50 lat
M-50 - grupa mężczyzn w wieku od 51 do 60 lat
Mg-ATP-aza - enzym (ATP-aza) aktywowany przez jony magnezu
OUN - ośrodkowy układ nerwowy
PFK - enzym fosfo-frukto-kinaza
Pi - reszta fosforanowa
Pmax - maksymalna moc podczas próby ergometrycznej
PtN - połowa czasu narastania siły
PtR - połowa czasu relaksacji
PV - parvalbumina
R - promień przyłożenia siły podczas pomiarów MVC
SS - siateczka sarkoplazmatyczna
ST - włókna mięśniowe wolno kurczące się
St-20 - grupa młodych mężczyzn, w wieku od 20 do 25 lat (studenci wychowania fizycznego)
S-60 - grupa starszych mężczyzn, w wieku powyżej 60 lat
Sz-Mł - grupa "szybka" młodsza, mężczyźni (studenci wychowania fizycznego) o wysokiej wartości
Sz-St - grupa "szybka" starsza; mężczyźni powyżej 50. roku życia, o wysokiej wartości maksymalnego gradientu narastania siły
tKN - czas końcowego narastania siły
tKR - czas końcowej relaksacji
tMVC - czas osiągania MVC
TnC - podjednostka C troponiny
tPN - czas późnego narastania siły
tPR - czas późnej relaksacji
tRK - czas reakcji końcowej
tRP - czas reakcji początkowej
tWN - czas wczesnego narastania siły
tWR - czas wczesnej relaksacji
V - prędkość obrotów pedałami ergometru [obr./min]
V0 - graniczna liczba obrotów, gdy zastosowana wartość siły oporu wynosi 0
W-Mł - grupa "wolna" młodsza; mężczyźni (studenci wychowania fizycznego) o niskiej wartości maksymalnego gradientu narastania siły
W-St - grupa "wolna" starsza; mężczyźni powyżej 50. roku życia, o niskiej wartości maksymalnego gradientu narastania siły
ZŁN - mięsień zginacz łokciowy nadgarstka
ZPN - mięsień zginacz promieniowy nadgarstka
Pamięci moich Rodziców
Spis treści
- 1.1 ZMIANY ZACHODZĄCE W SKŁADZIE CIAŁA Z WIEKIEM
- 1.2. ZMIANY ZACHODZĄCE Z WIEKIEM W SKŁADZIE RÓŻNYCH TYPÓW WŁÓKIEN MIĘŚNIOWYCH
- 1.3. MECHANIZMY ODPOWIEDZIALNE ZA GENEROWANIE SIŁY MIĘŚNIOWEJ
- 1.4. MECHANIZM POWSTAWANIA RELAKSACJI
- 1.5. CHARAKTERYSTYKA PRZEBIEGU RELAKSACJI
- 1.6. ZMIANY SIŁY MIĘŚNIOWEJ Z WIEKIEM
- 1.7. OCENA SZYBKOŚCI NARASTANIA SIŁY I RELAKSACJI
- 1.8. ZMIANY W PRZEBIEGU NARASTANIA SIŁY I RELAKSACJI ZACHODZĄCE Z WIEKIEM
- 1.9. DŁUGOŚĆ MIĘŚNIA A SZYBKOŚĆ NARASTANIA SIŁY I RELAKSACJI U OSÓB W RÓŻNYM WIEKU
- 1.10. CHARAKTERYSTYKA MIĘŚNI O WYSOKIM LUB NISKIM MAKSYMALNYM GRADIENCIE NARASTANIA SIŁY
- 1.11. MOC MIĘŚNIOWA I ZMIANY JEJ POZIOMU, ZACHODZĄCE Z WIEKIEM
- 1.12. CELE PRACY
- 1.13. GŁÓWNE HIPOTEZY BADAWCZE
W przebiegu rozwoju ontogenetycznego człowieka możemy wyróżnić 3 główne okresy: wzrastania organizmu, jego stabilizacji oraz starzenia się. Granice między nimi są niezauważalne, a wiek, w którym występują, może znacznie różnicować poszczególnych osobników. W kolejnych fazach życia występują nie tylko zmiany ilościowe, charakteryzujące organizm człowieka, zmienia się również w bardzo istotny sposób funkcjonowanie różnych jego narządów oraz całych układów.
Jedną z podstawowych cech charakteryzujących organizm człowieka jest jego zdolność do wykonywania pracy fizycznejo różnej intensywności i czasie trwania. W szczególny sposób zależy ona od sprawności układu mięśniowego, krążenia i oddychania. Ich funkcjonowanie wykazuje ścisłe wzajemne powiązanie. Możliwości wykonywania wysiłków w kolejnych okresach życia zmieniają się znacząco i zależą nie tylko od wieku osobnika, ale także od indywidualnych, uwarunkowanych genetycznie predyspozycji oraz od poziomu aktywności fizycznej. Postępujący spadek wydolności jest jednym z przejawów biologicznego procesu starzenia się organizmu i wiąże się z pogarszaniem się funkcjonowania układu krążenia, oddychania, nerwowo-mięśniowego oraz obniżeniem intensywności przemiany materii. Wynikiem tych zmian jest ograniczenie możliwości wykonywania codziennych czynności życiowych.
Dużą rolę w prewencyjnej działalności zdrowotnej odgrywa podtrzymywanie znacznej aktywności ruchowej. Jest ona również niezbędna dla utrzymywania wysokiej wydajności związanej z zawodową pracą fizyczną. Na postępujący z wiekiem spadek wydolności fizycznej coraz istotniejszy wpływ wywiera brak okazji do wykonywania niektórych, codziennych czynności ruchowych, takich jak chodzenie, poruszanie się po schodach itp. Badania amerykańskie [Jackson i wsp., 1995] wskazują, że wiele osób powyżej 65. roku życia nie jest w stanie wykonywać zwyczajnych, wymagających niewielkiego nawet wysiłku fizycznego, czynności ruchowych. Ponad 51% nie może wykonywać cięższych prac domowych, a około 33% nie potrafi przejść 0,5 mili. Temu stanowi towarzyszą niekorzystne zmiany w składzie ciała, ograniczające możliwości wysiłkowe człowieka.
Obserwowane u mężczyzn w okresie od 30. do 70. roku życia zmniejszenie masy mięśniowej (sarkopenia) jest znaczne, wynosi około 23% i wiąże się ze spadkiem poziomu rozwijanej siły [Fleg i Lakata, 1988]. Istotny wpływ na ten stan wywiera obniżający się poziom biologicznie czynnego testosteronu (od 40. do 70. roku życia o ok. 30%) oraz hormonu wzrostu [Bemben i wsp., 1995]. Ten sam zespół wykazał, że u mężczyzn w wieku od 20 do 74 lat, pomimo utrzymywania względnie stałego poziomu beztłuszczowej masy ciała (przy zwiększaniu się masy całkowitej), następował systematyczny spadek wydolności badanych mięśni kończyn górnych [Bemben i wsp., 1996]. Począwszy od 30. roku życia obserwuje się zwiększenie zawartości tkanki tłuszczowej (FM) z jednoczesnym obniżeniem procentowego udziału tkanki szczupłej (LBM). Jest to związane z redukcją białek mięśni, z jednoczesnym utrzymaniem ich zawartości w pozostałych tkankach [Cohn i wsp., 1980]. Już od 30. roku życia zmniejsza się przekrój poprzeczny mięśni, a wzrasta zawartość tkanki łącznej i tłuszczu wew-nątrzmięśniowego [Rogers i Evans, 1993]. U mężczyzn po ukończeniu 4. dekady życia zmienia się także rozmieszczenie tłuszczu; jego zawartość w tułowiu rośnie, a w kończynach maleje. Istotniejsze zmiany całkowitej masy ciała zauważa się dopiero około 50. roku życia, natomiast LBM spada około 20 lat później [Bemben i wsp., 1995]. Redukcji LBM towarzyszy zmniejszanie całkowitej zawartości wody w organizmie. Spada również poziom wydalanej z moczem kreatyniny, związany z coraz mniejszym nasileniem spoczynkowej przemiany materii [Evans, 1986]. Utrzymuje się ona na stałym poziomie do ok. 45. roku, po czym stopniowo obniża się (w ciągu 50 lat o ok. 30%) [Rogers i Evans, 1993].
Zmiany przebiegające we włóknach mięśniowych w procesie starzenia się organizmu oraz ich przyczyny nie zostały w pełni wyjaśnione. Z wielu badań [np. Larsson i Ansved, 1988; Petrigrew i Noble, 1991] wynika, że z wiekiem zmienia się stosunek liczbowy włókien mięśniowych ST do FT. Jest to spowodowane zwiększoną atrofią włókien FT, przy stałej liczbie włókien ST lub większą aktywnością procesów reinerwacji w motoneuronach jednostek wolnokurczliwych [Kanda i Hashizume, 1989]. Golnick i wsp. [1972] wykazali w swoich badaniach 36% udział włókien ST w mięśniach 20-30-letnich mężczyzn, podczas gdy u 30-50-letnich wynosił on 44%. Larsson [1978] stwierdził natomiast, że u 20-29-latków włókna ST stanowią 39%, a u 60-65-letnich mężczyzn 66% ogółu włókien. Jednakże badania polegające na badaniu próbek całych mięśni, prowadzone np. przez Lexella i wsp. [1983], wykazały, że stosunek liczby włókien typu ST i FT w ciągu życia jest stały, a liczba włókien obu typów zmniejsza się w tym samym stopniu. Takie spostrzeżenia potwierdziły wyniki uzyskane przez Grimby i Saltina [1983] oraz Sato i wsp. [1984]. Z późniejszej pracy Lexella [1993] wynika, że ogólna liczba włókien mięśniowych u 80-letnich osób, w stosunku do osób młodych, jest znacząco mniejsza. Jednocześnie niepodważalny jest fakt wyraźniejszego, w porównaniu z włóknami ST, zmniejszania się przekroju włókien FT. U 80-letnich osób jest on, w porównaniu z osobami młodymi, o około 26% mniejszy. Szczególnie podatne na zmiany są włókna FTb, zarówno u kobiet jak i u mężczyzn [Lexell i wsp., 1988]. Nie zmieniają się natomiast wymiary włókien ST [Aniansson i wsp., 1986]. Ten proces może znacząco ograniczać siłę mięśni osób starszych, a występujący spadek szybkości skurczów mięśniowych wiąże się przede wszystkim ze zmniejszaniem częstotliwości pobudzania w motoneuronach [Newton i wsp., 1988].
Kluczową rolę dla przebiegu skurczu mięśnia odgrywają jony Ca2+, które po uwolnieniu z siateczki sarkoplazmatycznej (SS) inicjują i kontrolują przebieg procesów prowadzących do wytworzenia połączenia aktywnych postaci miozyny z miofilamentem aktynowym. Dopóki komórka mięśniowa jest pobudzana, a jony wapnia są przyłączane do TnC, dochodzi do wielokrotnego łączenia, generowania siły, a następnie rozłączania mostków poprzecznych, przy zachodzącej hydrolizie ATP. Jego skutkiem jest wytworzenie napięcia mięśnia, skrócenie jego długości lub jednoczesna zmiana obu wielkości, w zależności od warunków pracy mięśnia.
W skurczu izometrycznym zmiany strukturalne, którym poddane są mostki, są niewielkie, natomiast duże zmiany w ruchu ślizgania mostka zachodzą, kiedy występuje skracanie mięśnia. Rozwijanie siły w izometrii poprzez ruch mostka - w którym generuje on siłę - następuje do momentu, kiedy element elastyczny mostka osiąga długość 2 nm [Piazzesi i wsp., 1997].
Szybkość cyklicznej pracy mostków poprzecznych odgrywa istotną rolę zarówno podczas narastania siły, jak i relaksacji. Mostki poprzeczne można więc traktować jako niezależne generatory siły, których szybkość przechodzenia w stan "mocnego" generowania siły wpływa na szybkość skurczu mięśniowego [Huxley, 1957; Huxley i Simmons, 1972]. Przyjmuje się, że kinetyka mostków poprzecznych, uwarunkowana szybkością przyłączania do nich Ca2+, należy do czynników wpływających w istotny sposób na szybkość narastania siły i na relaksację [Piazzesi i wsp., 1997].
Maksymalną wartość siły uzyskanej podczas skurczu dowolnego określa się jako maksymalną dowolną siłą izometryczną (MVC). Jej wielkość zależy głównie od ilości pobudzonych jednostek motorycznych, przekroju fizjologicznego mięśnia, rodzaju i wielkości włókien mięśniowych oraz siły rozwijanej przez każdy z mostków poprzecznych. MVC jest osiągana zazwyczaj w czasie od l s do 3 s [Bemben i wsp., 1990; Morris i wsp., 1983], wykazując znaczne indywidualne wahania. Jest ona uzależniona między innymi od właściwości kurczliwych mięśni oraz badanej grupy mięśniowej.
W przebiegu narastania siły w czasie (F-t) wyróżnia się trzy fazy: pierwszą - najszybszą fazę wczesnego narastania, obejmującą przyrost do 50% MVC, drugą - późnego narastania, definiowaną jako wzrost siły od 50 do 80% MVC. Trzecia, najwolniejsza faza obejmuje zakres od 80 do 100% MVC [Jaskólska, 1998]. Najszybsze narastanie siły ma miejsce, gdy osiąga ona poziom ok. 30% MVC. Jest to moment maksymalnego gradientu narastania siły (MGN). W pojedynczym, całkowicie pobudzonym włóknie, gradient ten jest przypuszczalnie limitowany przez szybkość przejścia mostków ze stanu "słabego" rozwijania siły w stan "mocnego" jej rozwijania. Na przebieg każdej z tych faz wpływają częściowo inne mechanizmy odpowiadające za narastanie siły. Według Milner-Brown i Stein [1973], Freund i wsp. [1975] oraz Kukulki i Clamanna [1981], w początkowej fazie skurczu (do uzyskania poziomu 50% MVC) głównym mechanizmem wpływającym na wzrost siły jest rekrutacja jednostek motorycznych [Oishi i Nigorikawa, 1988], uwalnianie jonów Ca2+ z SS i kinetyka mostków poprzecznych. Zależy ona również od liczby równocześnie aktywowanych, położonych równolegle względem siebie mostków [Ashley i wsp., 1993; Fitts i Balog, 1996; Szczęsna i wsp., 1996; Viitasalo i Komi, 1981a].
W późniejszych fazach szybkość narastania siły zmniejsza się. Najwolniejsze tempo jest w końcowej fazie (od 80 do 100% MVC) i zależy przede wszystkim od zmiany częstotliwości wyładowań już pobudzonych jednostek motorycznych oraz od kinetyki mostków miozynowych [Oishi i Nigorikawa, 1988]. Sposób aktywacji jednostek motorycznych w mięśniu zależy jednak od wielkości i typu mięśnia [Kukulka i Clamann, 1981; Laframboise i Cafarelli, 1994]. Jednocześnie można zauważyć, że wraz ze zmianą szybkości narastania siły mięśnia zmienia się jego sztywność. Na ten stan wpływają zarówno mostki poprzeczne, jak i elementy sprężyste mięśnia [Edman i Lou, 1989; Piazzesi i wsp., 1997; Proske i Morgan, 1984; Rack i Westbury, 1972]. Przypuszcza się, że zwiększona sztywność elementów sprężystych mięśnia wpływa na szybsze narastanie siły, wyrażanej przez większy MGN [Barclay, 1992; Mero i wsp., 1981; Viitasalo i Komi 1981b].
W momencie wygaśnięcia potencjału czynnościowego ustaje uwalnianie jonów Ca2+, a rozpoczyna się ich wychwytywanie przez SS. Proces ten zapoczątkowuje cykl przemian, w których mięsień przechodzi w stan pełnego rozluźnienia. Mechanizm relaksacji mięśnia nie jest dotychczas w pełni wyjaśniony. Jej rozpoczęcie i dalszy przebieg zależy w głównej mierze od szybkości zaniku czynności bioelektrycznej mięśni i derekrutacji jednostek motorycznych. Gdy stężenie wapnia w cytoplazmie osiągnie 200 nM, wówczas rozpada się kompleks TnC-Ca2+, gdyż powinowactwo sarkoplazmatycznej pompy wapniowej do Ca2+ jest większe niż Ca2+ do TnC. Przebieg relaksacji zależy głównie od stężenia Ca-ATP-azy w cysternach końcowych [Fryer i Neering, 1986; Dulhunty, 1990]. Pompę wapniową wspomagają również inne białka (parvalbumina, kalmodulina, kalsekwestryna) oraz mitochondria, które obniżają poziom Ca2+ poprzez przyłączanie reszty wolnego Ca2+, szczególnie gdy tempo ich wychwytywania przez SS jest obniżone. Stwierdzono, że stężenie parvalbuminy we włóknach FT jest większe niż we włóknach typu ST [Barquin i Lebacq, 1992; Gillis, 1985; Müntener i wsp., 1995]. Przebieg relaksacji jest też uzależniony od kinetyki mostków poprzecznych oraz od oddawania energii elastycznej przez wszystkie elementy sprężyste mięśnia [Gillis, 1985; Gowitzke i Milner, 1988]. Dużą rolę odgrywa aktywność fosfatazy, która jest enzymatycznym kluczem przebiegu relaksacji. Jest ona aktywowana przez obniżenie w komórce poziomu wapnia, katalizując defosforylację lekkich łańcuchów miozynowych [Pollack, 1990].
Według aktualnych poglądów, w relaksacji po izometrycznym skurczu tężcowym, w wyizolowanym włóknie mięśniowym wyodrębnia się dwie fazy: wczesną - liniową oraz późną - szybką (wykładniczą) [Gurfinkel i wsp., 1992; Huxley i Simmons, 1970; Westerblad i Lannergren, 1991]. Faza wczesna charakteryzuje się liniowym spadkiem napięcia o około 25%. Podczas tej fazy następuje względnie stały i wolny spadek napięcia mięśnia, ale nie stwierdza się zmian długości sarkomerów [Edman, 1980; Edman i Flitney, 1982; Huxley i Simmons, 1970]. Relaksacja obejmuje stopniowo całe włókno i nie zależy od częstotliwości pobudzania [Westerblad i Lannergren, 1991]. Ponadto, szybkość obniżania stężenia wewnątrzkomórkowego Ca2+ w tej fazie zmniejsza się gwałtownie, może jednak być bardzo zróżnicowana [Cannell, 1986; Wahr, 1994]. W fazie późnej relaksacji napięcie mięśnia spada zgodnie z przebiegiem krzywej wykładniczej, a relaksacja nie przebiega równomiernie wzdłuż całego włókna. Charakterystyczny dla tej fazy jest szybki spadek napięcia, powiązany ze zmianą długości sarkomerów [Edman, 1980; Edman i Flitney, 1982]. Spadek napięcia w fazie późnej relaksacji zależy od częstotliwości stymulacji wywołującej napięcie mięśnia [Huxley, 1980; Westerblad i Lannergren, 1991]. Wyższa częstotliwość wywołuje większy maksymalny gradient relaksacji (MGR) w porównaniu z pobudzeniami z niższą częstotliwością [Wahr, 1994]. Wewnątrzkomórkowe stężenie wapnia podczas późnej relaksacji obniża się powoli, a może nawet przejściowo wzrastać [Cannell, 1986]. Szybka faza relaksacji zależy głównie od szybkości rozłączania mostków i tylko częściowo jest zależna od szybkości usuwania Ca2+. Przebieg fazy relaksacji po skurczu dowolnym jest powiązany również z aktywnością mięśni synergistycznych i antagonistycznych, co ma bardzo istotne znaczenie podczas wykonywanych z dużą szybkością ruchów cyklicznych i odruchów obronnych. Zwiększenie szybkości relaksacji przyspiesza możliwość rozwinięcia następnego skurczu, co decyduje o skuteczności ruchów dowolnych.
Siła mięśniowa jest cechą ściśle powiązaną ze zmianami przekroju mięśni, udziałem poszczególnych typów włókien oraz skutecznością pobudzania jednostek motorycznych. Do 50. roku życia utrzymuje się względnie stały poziom siły, chociaż z badań Kandy i Hashizume [1989] wynika, że spadek poziomu MVC wydaje się rozpoczynać już od 30. roku życia. Wyraźniejsza jej redukcja następuje od 50. do 70. roku [Booth i wsp., 1994]. W 6. i 7. dekadzie życia MVC zmniejsza się po ok. 15%, a później, w ciągu kolejnych dekad nawet o 30% [Harries i Bassey, 1990; Larsson i Karlsson, 1978]. Redukcja siły w większym stopniu dotyczy mięśni kończyn dolnych niż górnych [McDonagh i wsp., 1984; Vandervoort i McComas, 1986]. To zjawisko nie jest w pełni wyjaśnione, przypuszcza się jednak, że może być związane z postępującym zmniejszeniem obciążania oraz zmianą charakteru wysiłków wykonywanych przez te grupy mięśni. Najnowsze badania wykazały, że siła najbardziej zależy od zmian wymiarów włókien mięśniowych, a w mniejszym stopniu od przeobrażeń zachodzących w samej strukturze mięśnia [Lexell i wsp., 1983]. Sama atrofia nie wyjaśnia w pełni zmiany MVC z wiekiem, gdyż następujący wówczas spadek siły jest znacznie większy (od 10 do 22%, w zależności od prędkości ruchu) niż powstały w tym samym czasie ubytek masy ciała lub masy komórek mięśniowych [Bruce i in., 1989; Davies i wsp., 1986; Vandervoort i Mc Comas, 1986; Young i wsp., 1985]. Obserwowane zmniejszenie siły wynika zapewne z wpływu innych czynników, wywołanych samym procesem starzenia się, stopniowym ograniczaniem z wiekiem aktywności fizycznej ludzi lub obu tych czynników jednocześnie. Z badań Younga i wsp. [1985] wynika, że wskaźnik siły maksymalnej mięśnia do jego przekroju poprzecznego (MVC/CSA) jest u starszych mężczyzn niższy niż u młodych mężczyzn, a podobny jak u młodych i starszych kobiet. Autorzy ci sądzą, iż główną przyczyną spadku siły u starszych badanych może być znaczące zmniejszenie ich aktywności ruchowej. Tego spostrzeżenia nie podzielają jednak Frontera i wsp. [1991]. W badaniach osób starszych nie wykazali oni różnic w poziomie MVC przeliczanej na powierzchnię przekroju pełnego mięśnia, chociaż ich siła bezwzględna jest wyraźnie mniejsza niż u młodszych.
Bardzo istotnym dla funkcjonowania mięśni jest proces obumierania neuronów ruchowych, zmniejszenia ich rozmiarów i ograniczania liczby połączeń nerwowych w obrębie centralnego układu nerwowego. Przypuszcza się, że zmiany zachodzące wraz z wiekiem w obrębie układu nerwowego są pierwotne w stosunku do zmian dokonujących się w mięśniach i mogą odgrywać podstawową rolę w ograniczaniu zdolności wysiłkowej [Celichowski, 1999]. Zastosowanie w badaniach elektromiografii wykazało malejącą z wiekiem liczbę pobudzanych jednostek motorycznych, pogorszenie się aktywacji neuronów rdzenia kręgowego oraz przewodnictwa nerwowo-mięśniowego. Oprócz obniżenia siły, na skutek tych procesów dochodzi do spowolnienia jej narastania [Lewis i Brown, 1994]. Jest to spowodowane również zmianami w przestrzennym ułożeniu włókien FT i ST. Staje się ono z wiekiem bardziej uporządkowane. Na skutek stale przebiegających procesów odnerwiania i reinerwacji, w obrębie układu mięśniowego dochodzi z wiekiem do wzrostu wielkości jednostek motorycznych [Kanda i Hashizume, 1989] oraz procesu grupowania się włókien mięśniowych, tzn. skupisk włókien otoczonych przez komórki mięśniowe tego samego typu ("enclosed"). U młodych osób przeważa natomiast nieuporządkowane ułożenie ("ungrouping") włókien. W takim ułożeniu włókna tego samego typu nie grupują się, lecz między nimi znajdują się włókna innego typu [Evans, 1986; Golnick i wsp., 1972;Grimby i Saltin, 1983]. Wyraźniej uporządkowany układ uwidacznia się jednak dopiero po ukończeniu 60. roku życia [Lexell i wsp., 1986]. Zmiany te mają niewątpliwy wpływ na synchronizację pobudzania włókien mięśniowych i wpływają na poziom rozwijanej siły, jak też na koordynację i płynność ruchów.
Istotne jest spostrzeżenie, że podstawowym warunkiem utrzymania wysokiego poziomu sprawności mięśni jest odpowiednio duża aktywność fizyczna, która umożliwia utrzymanie do późnego wieku masy i siły mięśni oraz wolniejszy jej spadek z wiekiem. Zbyt małe obciążanie mięśni pracą fizyczną jest głównym powodem szybko postępującej ich atrofii [Booth i wsp., 1994]. Klitgaard i wsp. [1990] wykazali, że 50-letni mężczyźni stosujący trening siłowy mieli przekrój i siłę mięśniową porównywalną z 28-latkami o małej aktywności fizycznej.Jednocześnie wykazano, że odpowiednio dozowany trening siłowy prowadzi do znaczącej hipertrofii włókien mięśniowych oraz poprawia stopień aktywacji jednostek motorycznych nie tylko u osób w średnim wieku, ale również u starszych. Warunkiem jest odpowiednia progresja obciążeń oraz czas ich stosowania [Häkkinen i Pakarinen, 1994; Frontera i wsp., 1988; Rogers i Evans, 1993].
Przebieg narastania siły (zarówno w skurczach dowolnych oraz elektrycznie wywoływanych skurczach tężcowych) jest zazwyczaj wolniejszy od fazy relaksacji [Häkkinen i wsp., 1984; Jaskólska, 1998]. Różnice w przebiegu narastania siły i relaksacji wynikają z faktu, że podczas relaksacji występuje odwrotna kinetyka jonów Ca2+ i mostków miozynowych, związana z ich przechodzeniem z tzw. stanu "mocnego" w stan "słabego" rozwijania siły. Szybszy przebieg może również wynikać z uwalniania energii elastycznej przez elementy sprężyste mięśni [Gowitzke i Milner, 1988]. Ponieważ mechanizmy odpowiedzialne za narastanie siły są w pewnym stopniu odwrotnością procesów decydujących o relaksacji, można przypuszczać, że wysokie wartości MGN, wynikające z predyspozycji szybkościowych, będą wpływały również na zwiększenie szybkości relaksacji. Potwierdzać może to fakt, że jednostki motoryczne typu FT mają krótszy czas połowy relaksacji [Sica i McComas, 1971]. Badania relaksacji są najczęś-ciej wykonywane na mięśniach izolowanych, pobudzanych przy użyciu stymulacji elektrycznej. Przebieg relaksacji w warunkach przyżyciowych nie doczekał się pełnego wyjaśnienia. Ten stan wynika prawdopodobnie z wpływu na przebieg relaksacji wielu czynników, związanych zarówno z samym mięśniem, z funkcją układu nerwowego oraz ze współdziałania różnych grup mięśniowych (koordynacja mięśni agonistów i antagonistów).
Do oceny sprawności narastania siły podczas skurczu dowolnego wykorzystuje się najczęściej czas osiągania maksymalnej siły izometrycznej (tMVC), czas osiągania 50% maksymalnej siły izometrycznej (PtN) oraz maksymalny gradient narastania siły (MGN) [Viitasalo i Komi, 1981a,b]. MGN występuje zazwyczaj przy około 30% MVC całkowicie pobudzonego włókna pojedynczego i zależy od szybkości przechodzenia mostków ze stanu słabego rozwijania siły w stan mocnego rozwijania siły. Przy ocenie relaksacji u ludzi, po skurczach dowolnych lub wywołanych stymulacją, najczęściej stosowanymi wskaźnikami są czas 50% relaksacji (PtR) i maksymalny gradient relaksacji (MGR) [Duchateau i Hainaut, 1985; Duchateau i wsp., 1987; Gillis, 1985; Golnick i wsp., 1991]. Z uwagi na to, że maksymalne gradienty oraz czas narastania 50% MVC i czas 50% relaksacji obejmują tylko wczesne fazy narastania siły i relaksacji oraz mając na uwadze wyniki badań Jaskólskiego i wsp. [1999] oraz Jaskólskiej [1999a,b], uznano za celowe, aby w ocenie narastania jak i relaksacji uwzględniać także gradienty wczesnej, późnej i końcowej fazy. Mogą one bardziej różnicować przebieg tych części cyklu skurczu mięśniowego [Goldman i wsp., 1982] u młodszych i starszych osób [Golnick i wsp., 1991].
Z wiekiem obserwuje się szereg zmian zachodzących w samych mięśniach bądź wynikających ze zmian zachodzących w układzie nerwowym. Są one skutkiem zanikania części motoneuronów, spowolnienia przewodnictwa we włóknach nerwowych i synapsach oraz mniejszej aktywności szeregu enzymów mięśniowych [Murray i wsp., 1980]. Zmienia się również stosunek (głównie przekroju) włókien FT do ST. Te zmiany, z teoretycznego punktu widzenia, powinny spowolnić przebieg zarówno narastania siły jak i relaksacji pracujących mięśni. Znalazło to potwierdzenie m. in. w badaniach van Schaik i wsp. [1994] oraz Vandervoorta i McComasa [1986]. W pracach Jaskólskiej [1998], Barańskiego [2000] oraz Naczka [2000] dokonano bardziej szczegółowej analizy przebiegu fazy relaksacji u osób w różnym wieku. Wynika z nich, że charakterystyka szybkości narastania siły i relaksacji tylko za pomocą maksymalnych gradientów narastania siły i relaksacji oraz czasu połowy narastania siły i relaksacji nie odzwierciedla w pełni zmian właściwości mięśni szkieletowych. Ich przebieg jest bardziej złożony i wymaga użycia dokładniejszych miar.
Zmiany parametrów narastania siły mięśniowej i relaksacji, zachodzące z wiekiem oraz przyczyny tych zmian nie są dostatecznie rozpoznane i wyjaśnione. Występują one już od wczesnego wieku dorosłego, jednakże dopiero w 7. dekadzie życia znacznie się nasilają. W badaniach z udziałem osób starszych [Davies i wsp., 1986] stwierdzono znaczące wydłużenie czasu osiągania MVC i czasu relaksacji mięśnia trójgłowego ramienia. Wykazano, że był to wynik zachodzących z wiekiem zmian głównie we włóknach FT, aktywowanych przede wszystkim w czasie szybkich skurczów oraz zmian zachodzących w kinetyce Ca2+ w komórce mięśniowej podczas jej skurczu [Vandervoort i Mc Comas, 1986; Edström i Grimby, 1986]. Skutkiem tych zmian jest postępujący z wiekiem spadek dynamiki pracy mięśni, co zmniejsza m. in. ich zdolność do szybkiego narastania siły w odruchach obronnych [Vandervoort i Hayes, 1989]. Przypuszcza się, że główną przyczyną mniejszej szybkości ruchów jest atrofia komórek mięśniowych. Powoduje ona wprawdzie jednakowy spadek liczby obu typów włókien, ale zmniejszenie powierzchni przekroju dotyczy głównie włókien FT [Lexell i wsp., 1983]. Nie stwierdza się natomiast spadku przekroju włókien ST. Ten proces może częściowo wpływać na postępujące z wiekiem zwolnienie szybkości skurczu [Lexell i wsp., 1988; Booth i wsp., 1994]. Wyniki badań prowadzonych m. in. przez Anianssona i wsp. [1981] wskazują, że na dynamikę ruchów może również wpływać spadek aktywności enzymatycznej miokinazy (MK). W badaniach próbek mięśni starszych mężczyzn, po dokonaniu segregacji włókien ST i FT, spadek aktywności MK w obu typach włókien wyniósł 45% w stosunku do poziomu stwierdzonego u młodych, dorosłych mężczyzn. Jak przypuszczają autorzy, główną przyczyną tego procesu jest ograniczone pobudzanie włókien FT podczas codziennej aktywności ludzi starszych, którzy rzadko rozwijają duże napięcia mięśniowe. Nie w pełni tłumaczy to jednak znaczący spadek aktywności miokinazy we włóknach ST. Wykazano również, że MK jest enzymem skorelowanym przede wszystkim z rozwijaną siłą mięśniową, co wyjaśnia fakt stopniowego jej spadku wraz ze zmniejszaniem się aktywności tego enzymu we włóknach FT. Nie znaleziono przy tym różnic w aktywności innych enzymów wpływających na wykonywanie intensywnych wysiłków fizycznych, np. Mg-ATP-azy czy PFK. Wiadomo również, że spoczynkowa zawartość fosfagenu mięśniowego oraz tempo jego resyntezy są u starszych i młodych podobne i nie powinny wpływać na dynamikę ruchu [Rogers i Evans, 1993;Taylor i wsp., 1992]. Zmniejszenie gradientu narastania siły jak i relaksacji może ponadto zależeć od powiększania się jednostek motorycznych, zmniejszania się liczby aktywnych neuronów rdzenia kręgowego i spowolnienia rytmu ich pobudzania. Pogarsza się również przewodnictwo nerwowe i synaptyczne [Rogers i Evans, 1993]. Znaczące jest też wydłużenie czasu reakcji motorycznej, spowodowane zmianą integracji pomiędzy mięśniami a tkanką łączną [Lewis i Brown, 1994]. Zmiana własności fizjologicznych i mechanicznych tych tkanek wywołuje czasowe opóźnienie w wytwarzaniu napięcia wystarczającego do wywołania ruchu. Wszystkie te przeobrażenia zachodzą początkowo w wolnym tempie i są trudne do zaobserwowania, jednakże - podobnie jak w przypadku MVC - wyraźnie nasilają się od 7. dekady życia. Postępujące procesy starzenia nakładają się na skutki stopniowego ograniczania własnej aktywności ruchowej. Dochodzi wówczas do znacznego obniżenia sprawności ruchowej, wywołanej przede wszystkim spadkiem siły mięśniowej, która ogranicza rozwijanie maksymalnej mocy. Pojawiające się w tym czasie zaburzenia w utrzymaniu równowagi powodują często spotykane (zwłaszcza w wieku starczym) upadki grożące złamaniami kości, przeważnie dotkniętych nasiloną osteoporozą [Vandervoort i Hayes, 1989].
Powszechnie znany jest fakt zmiany napięcia mięśni, rozwijanego podczas skurczu izometrycznego, w zależności od jego długości. Największą wartość ma ono przy optymalnej długości (Lo). Przy zmniejszonej i zwiększonej długości mięsień rozwija mniejsze napięcie. Dość dobrze poznana jest ta zależność w odpowiedzi na doświadczalnie wywoływane skurcze pojedyncze lub tężcowe. Podczas dowolnych skurczów na tę zależność wpływa wiele dodatkowych czynników, takich jak pobudzenie włókien mięśniowych przez ich neurony ruchowe czy oddziaływanie mięśni antagonistycznych. Zmiana długości mięśnia jest wywołana przez zmianę położenia dźwigni kostnych stawów, w których te mięśnie działają. Z badań prowadzonych przez Wallinga-de Jonge i wsp. [1980] na mięśniach izolowanych zwierząt wynika, że w narastaniu siły podczas skurczu tężcowego podstawową rolę wydaje się odgrywać szybkość łączenia mostków poprzecznych (kinetyka mostków) oraz częstotliwość pobudzeń komórek mięśniowych, zapoczątkowana uwalnianiem jonów Ca2+ z siateczki sarkoplazmatycznej. Zmiana długości mięśnia (np. przy zmianie kąta stawowego) powoduje zmianę charakterystyki narastania siły. W mięśniu "szybkim" istotne zmniejszenie maksymalnego gradientu narastania siły występuje zarówno przy skróconym jak i wydłużonym mięśniu (od Lo-5% do Lo +5%). Natomiast w mięśniu "wolnym" - tylko przy jego wydłużeniu (Lo+5%).
Słabiej poznany jest proces relaksacji mięśnia. Badania prowadzone na mięśniach zwierząt pokazały, że zarówno podczas skurczu pojedynczego jak i tężcowego szybkość relaksacji zmniejszała się wraz ze zmianą długości mięśnia poza jego długość optymalną [Pagala 1980; Wallinga de Jonge i wsp., 1980]. Zmiany szybkości relaksacji zależą jednak od wielu czynników, m. in. od procentowego składu włókien mięśniowych. Z badań Wallinga de Jonge i wsp. [1980] wynika, że zmiana szybkości relaksacji wraz ze zmianą długości mięśnia nie jest jednolita w całym jej przebiegu i zależy głównie od stężenia ATP-azy wapniowej. Na przebieg wczesnej, liniowej fazy wpływa przede wszystkim szybkość obniżania poziomu Ca2+ w komórce oraz jego wychwytywanie przez siateczkę sarkoplazmatyczną. W drugiej, szybkiej części relaksacji, spadek siły zależy od częstotliwości stymulacji (wyższą częstotliwość cechuje większy maksymalny gradient relaksacji) oraz od szybkości rozłączania mostków. Ponieważ podczas tężcowego skurczu mięśnia "szybkiego" nie wykazano istotnych zmian w przebiegu relaksacji w zależności od długości, a były one wyraźnie zaznaczone w mięśniu "wolnym" [Wallinga-de Jonge i wsp., 1980], można sądzić, że w mięśniu mieszanym zmiany te nie będą wyraźnie zaznaczone.
W dostępnym piśmiennictwie nie znaleziono dokładnego opisu zmian siły mięśnia zachodzących z wiekiem, w zależności od jego długości oraz skutków tych zmian dla funkcjonowania ustroju w starszym wieku. Badania w zakresie tej tematyki są prowadzone bardzo rzadko i zazwyczaj przy użyciu stymulacji wywołującej skurcze pojedyncze (twitch) lub tężcowe (tetanus). Przy ich pomocy wykazano, iż zmiany zachodzące z wiekiem są prawdopodobnie umiejscowione głównie w samych mięśniach. Tylko w nielicznych pracach z udziałem osób w starszym wieku wykorzystano do badań skurcze dowolne. Z opracowania van Schaik i wsp. [1994] wynika, że - w porównaniu ze stymulacją elektryczną - w skurczu dowolnym zginaczy grzbietowych stopy występują z wiekiem większe, choć nieistotne, zmiany w zakresie podstawowych parametrów narastania siły i relaksacji we wszystkich kątach. Autorzy przypuszczają, że główną przyczyną zmian w fazie narastania jest zmniejszenie szybkości wiązania mostków poprzecznych, nie wynikające ze zmniejszonej aktywacji jednostek motorycznych (stwierdzony stopień ich pobudzenia jest identyczny jak w młodszych grupach - 96%). Ze względu na odmienne funkcje mięśni kończyn górnych i dolnych, interesujące jest zbadanie, czy istotne zmiany szybkości narastania siły pojawiają się również w mięśniach kończyn górnych i czy zakres tych zmian jest podobny do uzyskanych w badaniach mięśni kończyn dolnych. Ze względu na odmienne funkcje poszczególnych mięśni oraz różną ich aktywność, zmiany te mogą być znacznie zróżnicowane. Wydaje się jednak, że ocena powszechnie stosowanych wskaźników, takich jak MVC, czas osiągania MVC oraz czas połowy relaksacji (t50%R) mogą nie w pełni odzwierciedlać zachodzące z wiekiem zmiany właściwości mięśni przy różnej ich długości.
Podczas codziennej aktywności człowieka, obejmującej m. in. różne formy ruchowe kończyn górnych, takie jak np. ruchy sięgania, ruchy manipulacyjne lub chwytanie, siła mięśni oraz szybkość narastania siły i relaksacji ulegają zmianom także w zależności od kąta w stawie, nad którym te mięśnie przebiegają. Zależność siły mięśnia od jego długości jest podstawową właściwością decydującą o zdolności do rozwijania siły w naturalnych, przyżyciowych warunkach, czyli podczas codziennie wykonywanych przez człowieka ruchów. Dlatego też określenie zachodzących z wiekiem zmian siły, szybkości narastania tej siły i relaksacji w zależności od długości mięśni, poza walorem poznawczym, może mieć duże znaczenie praktyczne.
Predyspozycje człowieka do wykonywania ruchów z dużą prędkością lub do szybkiego narastania siły wynikają głównie z posiadania cech uwarunkowanych genetycznie. Dotyczą one zarówno sprawnego funkcjonowania somatycznej części układu nerwowego, jak również cech układu mięśniowego. Różnice w zawartości włókien mięśniowych FT i ST są powiązane z aktywnością niektórych enzymów, regulujących przebieg skurczu mięśniowego. Dokonujące się z wiekiem zmiany tkanki mięśniowej wywołują znany skutek w postaci spadku rozwijanej siły i zmniejszenia szybkości przebiegu skurczu mięśniowego. Nie spotyka się natomiast dokładnej charakterystyki zmian zachodzących z wiekiem pod względem predyspozycji siłowo-szybkościowych. Są one trudne do uchwycenia, gdyż większość ludzi cechuje równy udział włókien FT i ST, a zatem średni poziom cech uwarunkowanych takim składem włókien. Dokonująca się z wiekiem redukcja przekroju mięśni, dotycząca głównie włókien FT, pozwala na przypuszczenie, iż narastanie siły i relaksacja mogą przebiegać inaczej u osób z przewagą włókien FT, które decydują o dużej dynamice narastania i relaksacji siły, w porównaniu z ludźmi charakteryzującymi się przewagą włókien ST. Analiza mechanizmów skurczu mięśniowego wykazuje wyraźne ich powiązanie ze skutkiem, jakim jest zmniejszenie szybkości narastania siły oraz jej relaksacji z wiekiem. Nie wyjaśniono jednak dotychczas, od czego zależy wielkość tych zmian oraz jaki wpływ na ten proces wywiera genetycznie uwarunkowany udział różnego typu włókien mięśniowych, a w konsekwencji, jak zmieniają się parametry charakteryzujące szybkość przebiegu skurczu mięśniowego.
Szybkość skurczu jest uzależniona zarówno od czynników związanych z tkanką mięśniową, jak też od sprawności procesów przebiegających w układzie nerwowym, związanych z rodzajem i ilością pobudzanych motoneuronów oraz z częstotliwością wyładowań już zrekrutowanych jednostek motorycznych. Ważną rolę odgrywa funkcja siateczki sarkoplazmatycznej. Znaczący wpływ wywiera również aktywność ATP-azy miofibrylarnej, kinetyka mostków miozynowych oraz liczba tych mostków, położonych równolegle względem siebie i równocześnie aktywowanych [Viitasalo i Komi, 1981a]. Te ostatnie czynniki są istotne podczas skurczu izometrycznego w przypadku, gdy szybkość narastania siły jest wyrażona w N/s. Do rozwijania ruchów z maksymalną szybkością w różnych sytuacjach związanych ze zwykłymi sytuacjami dochodzi rzadko. Często natomiast spotyka się je w sporcie. Duże prędkości ruchu osiągane są przy optymalnym pobudzeniu dużej liczby jednostek motorycznych typu FT w mięśniach głównych oraz synergistycznych, przy jednoczesnej, odpowiednio szybko zachodzącej relaksacji mięśni antagonistycznych. Szybkość ruchu istotnie zależy wówczas od liczby sarkomerów położonych szeregowo. Nie jest wyjaśnione, czy liczba tych sarkomerów z wiekiem zmienia się, wpływając przez to na szybkość ruchów. Przy wykonywaniu ruchów z dużą częstotliwością szczególnie istotną rolę odgrywa koordynacja pobudzania i hamowania obu tych grup mięśniowych. Ze względu na postępujące z wiekiem zmniejszenie częstotliwości pobudzania, stopniowo zmniejsza się udział jednostek FT w generowaniu napięcia mięśniowego, a tym samym zmniejsza się szybkość ruchów [Celichowski, 1999]. Wymagają one rozwijania znacznego napięcia, co zależy również od dużej aktywności miokinazy. Enzym ten odgrywa istotną rolę w generowaniu siły, wpływając na metabolizm mięśnia przez obniżanie stężenia ADP (wzrasta stosunek ATP/ADP) oraz dostarczanie AMP, który jest silnym aktywatorem glikolizy.
Rekrutacja jednostek motorycznych w zwykłych, spontanicznych ruchach przebiega zgodnie z tzw. zasadą wielkości, opisaną po raz pierwszy przez Hennemana [1981]. Oznacza to, że najpierw aktywowane są małe motoneurony o niskim progu pobudliwości, unerwiające wolne włókna ST, a następnie rekrutowane są szybkie jednostki ruchowe o wyższym progu pobudzenia. Są to duże motoneurony unerwiające włókna mięśniowe FT. Według Grimby i Saltina [1983], podczas wykonywania bardzo dynamicznych i szybkich ruchów szyk rekrutacji może zostać odwrócony i wtedy jednostki FT mogą być aktywowane przed jednostkami ST. W ruchach, w których rozwijana jest maksymalna szybkość i siła, większy udział biorą jednostki szybkie. Należy jednak zaznaczyć, że w warunkach fizjologicznych nigdy nie dochodzi do jednoczesnej rekrutacji wszystkich jednostek ruchowych [Enoka, 1994a; Celichowski, 1998/1999]. Istotny jest również fakt, że szybkość przechodzenia mostków poprzecznych w stan "mocnego" rozwijania siły we włóknach FT jest większa niż we włóknach ST [Metzger i Moss, 1990]. Większa jest w nich także aktywność ATP-azy miofibrylarnej [Kozłowski i wsp., 1995]. Mając to na uwadze, można przyjąć, że im większy procentowy udział włókien typu FT w mięśniu, tym większa jest jego zdolność do rozwijania siły w czasie lub większej szybkości ruchu. Parametrem najczęściej stosowanym do charakterystyki szybkości narastania siły jest maksymalny gradient narastania. Uwarunkowania związane z szybkością przebiegu relaksacji zostały opisane w podrozdziale I.5.
Maksymalna moc rozwijana w ciągu kilku sekund, podczas wykonywania wysiłków o największej intensywności, jest bardziej użytecznym niż siła mięśniowa wskaźnikiem zdolności do wykonywania wysiłków dynamicznych. Warunkuje ona sprawność poruszania się oraz wykonywania wielu codziennych czynności, zwłaszcza u ludzi starszych [Mazzeo i wsp., 1998]. Jest także pośrednim wskaźnikiem intensywności uwalniania energii powstałej z ATP zgromadzonego w mięśniach, czyli rozwijania tzw. siły dynamicznej [Feretti i wsp., 1994]. Wiadomo, że maksymalna moc, podobnie jak siła, maleje z wiekiem. Nieznaczny spadek może się zaznaczać już w 3. dekadzie życia [Davies i wsp., 1983]. Grassi i wsp. [1991] w badaniach przekrojowych z udziałem 115 mężczyzn, w wieku od 40 do 75 lat, aktywnie uprawiających różne dyscypliny sportu wykazali, że niezależnie czy uprawiali szybkościowe czy wytrzymałościowe dyscypliny sportu, w tym przedziale wiekowym następuje niemal liniowy spadek Pmax (wyrażanej w watach i w watach/kg masy ciała), do poziomu ok. 50% mocy rozwijanej przez młodych sportowców. Moc wyrażana na LMV (objętość tkanki beztłuszczowej, mierzona przy użyciu rezonansu magnetycznego) zmniejszała się dwukrotnie wolniej. Była ona znacząco wyższa w grupie osób trenujących sporty szybkościowe niż nietrenujących lub uprawiających wytrzymałościowe dyscypliny sportu (do ok. 60. roku życia uzyskiwali oni zbliżone wyniki Pmax). Wykazano jednak, że spadek mocy do 50. roku życia jest niewielki i znacząco zależy od regularnej aktywności fizycznej. Natomiast Ecker [1990] wykazał, że największy spadek mocy wystąpił w 3. dekadzie życia, tak u osób o dużej jak i małej aktywności fizycznej. Jednakże poziom Pmax był u aktywnych znacznie większy, zwłaszcza gdy wyrażano go na kg masy ciała lub masy beztłuszczowej.
Ograniczenie wydolności fosfagenowej u osób w średnim wieku wynika głównie z mniejszej sprawności pobudzania nerwowo-mięśniowego, podczas gdy w późniejszym okresie ze spadku masy mięśni, wywołanej zmniejszeniem przekroju poprzecznego włókien (szczególnie FT) oraz ich liczby [Grassi i wsp., 1991]. Zmniejszenie przekroju mięśni jest głównym, ale nie jedynym czynnikiem spadku Pmax, gdyż jej redukcja jest większa niż rejestrowany w tym czasie spadek masy mięśni [Grassi i wsp., 1991]. W niektórych badaniach [Ferettii i wsp., 1994] wykazano, że obniżenie Pmax ma miejsce mimo niezmienionego przekroju mięśni. Istotny wpływ na ten stan wywiera, dokonująca się w mięśniach z wiekiem, zmiana zawartości tkanki łącznej i tłuszczowej, która maskuje (mimo tego samego przekroju) faktycznie postępujący spadek masy mięśni. Występuje jednak szereg innych czynników wpływających na rozwijaną Pmax. Do najistotniejszych zalicza się szybkość hydrolizy ATP (a więc i szybkość skurczu) oraz, w pewnym stopniu, zapas mięśniowego ATP (mimo dużych różnic poziomu rozwijanej mocy maksymalnej nie stwierdza się większych różnic jego zawartości pomiędzy sportowcami a osobami nietrenującymi w różnym wieku) [Davies i wsp., 1983; Feretti i wsp., 1994]. Pmaxjest też limitowana przez upośledzenie regulacji neuro-hormonalnej oraz, podobnie jak w przypadku siły mięśniowej, postępującą degeneracją alfa-motoneuronów [Davies i wsp., 1983]. Następuje też zmniejszenie aktywności ATP-azy miofibrylarnej, zwłaszcza we włóknach FTb [Clarkson i wsp., 1981; Narici i wsp., 1991]. Jednakże wpływ tych czynników na rozwijaną moc jest trudny do ustalenia.
Do oznaczania wydolności anaerobowej - fosfagenowej najczęściej stosowano próbę mocy fosfagenowej Margarii - Kalamena lub pomiar największej mocy podczas serii wyskoków, stosując patformę dynamograficzną [np. próba Bosco i wsp., 1983]. Bardzo wygodne do przeprowadzenia przy obecnym stanie techniki są próby ergometryczne, umożliwiające ciągłą rejestrację parametrów mechanicznych, podczas wykonywania krótkotrwałego wysiłku o supramaksymalnej intensywności. Ocenia się rozwijaną maksymalną moc, przy założonej sile oporu (np. Wingate Anaerobic Test). Istnieją jednak znaczne różnice mocy osiąganej przez tych samych badanych, przy zastosowaniu różnych wartości siły oporu, w zależności od płci, wieku i innych cech osobniczych. Doświadczalnie wykazano [Vandewalle i wsp., 1987], że zależność pomiędzy rozwijaną mocą (Pmax) a siłą oporu (F) ma przebieg paraboliczny, a jej maksimum występuje w połowie wartości granicznej siły oporu. Stwarza to możliwość optymalizacji doboru siły oporu, dla osiągnięcia indywidualnie największej mocy. Tym kryteriom odpowiada metoda Vandewalle i wsp. [1987], która zakłada istnienie ujemnej, liniowej zależności pomiędzy częstotliwością obrotów (V) podczas pracy na ergometrze a zastosowaną siłą oporu na obwodzie koła zamachowego ergometru (F), w zakresie od 100 do 200 obrotów/min. Próby wykonane z udziałem osób w różnym wieku i o różnym stanie wydolności wykazały, że tego typu wysiłki są przez nich dobrze tolerowane i wyraźnie różnicują badane osoby [Adach i wsp., 2000; Vandewalle i wsp., 1985; Winter i wsp., 1987; Winter, 1994].
W literaturze związanej z problematyką wieku dojrzałego i starszego występuje stosunkowo duża liczba prac dotyczących ludzi w tym okresie życia. Ocenia się jednak głównie wydolność ich układów krążenia i oddychania, które warunkują wydolność aerobową [Robinson i wsp., 1975; Jackson i wsp.,1995;Shepard, 1997]. Część badań dotyczy także zmian w układzie mięśniowym [np. Grimby i Saltin, 1983;Lexell i wsp., 1983]. Bardzo rzadko podejmuje się zagadnienia związane z wydolnością anaerobową. Tymczasem znaczna część czynności ruchowych, występujących w pracy zawodowej i codziennej aktywności fizycznej, jest związana z beztlenową-fosfagenową resyntezą ATP. Rzadko też ocenia się wzajemną zależność pomiędzy siłą mięśniową przejawianą w różnych warunkach pracy a poziomem wydolności anaerobowej, często decydującej o bezpieczeństwie i zdrowiu ludzi starszych. Z analizy literatury wynika, iż nie ma istotnych podstaw do twierdzenia, by zmiany dokonujące się w obrębie układu mięśniowego, krążeniowego czy oddechowego znacząco ograniczały możliwości wysiłkowe człowieka w tzw. średnim wieku. Nieco szybsze tempo zmian funkcjonalnych zaznacza się dopiero w 6.-7. dekadzie życia. Stwierdzony spadek poziomu siły maksymalnej lub rozwijanej mocy może wynikać głównie z ograniczania aktywności ruchowej [Ecker, 1990; Meredith i wsp., 1989]. Dokładniejszego wyjaśnienia wymaga również kwestia skuteczności oddziaływania na organizm różnych form aktywności fizycznej oraz jej wpływu na stan zdrowia ludzi w każdym wieku.
W niektórych badaniach wykazano wyraźne obniżenie sprawności funkcjonalnej różnych grup mięśniowych tych samych osób już w młodym wieku [Rogers i Evans, 1993; Frontera i wsp., 1991; Brooks i Faulkner, 1994; Kanda i Hashizume, 1989]. Z opracowań Campbella i wsp. [1973], Portera i wsp. [1995] czy Murray'a i wsp. [1980] wynika, że dokonujące się wraz z wiekiem zmiany, zarówno w samych mięśniach jak i ich motoneuronach, mogą mieć różne tempo, wywołując pogorszenie siły i szybkości jej narastania w różnych grupach mięśniowych. Duże grupy mięśni, które cechuje wysoka wartość rozwijanej mocy, pełnią przede wszystkim rolę lokomocyjną, zapewniają stabilizację ciała, także podczas wykonywania różnego rodzaju pracy fizycznej. Ich odpowiednia sprawność w starszym wieku zapobiega upadkom podczas poruszania się, ograniczając m. in. niebezpieczeństwo złamania kości. Mniejsze grupy mięśniowe kończyn górnych, ze względu na swoją mniejszą masę, nie są w stanie generować tak dużych wartości siły i mocy. Odpowiadają jednak za wykonywanie wielu bardziej precyzyjnych czynności manualnych. Funkcje obu tych grup mięśniowych nie wykazują ścisłego powiązania ze sobą, a przebieg zmian inwolucyjnych w mięśniach kończyn dolnych jest, zwłaszcza u mężczyzn, szybszy w porównaniu z kończynami górnymi. Przypuszcza się, że podstawową rolę może odgrywać tutaj stopień zaangażowania tych mięśni do regularnie wykonywanych czynności ruchowych, związanych z codzienną aktywnością fizyczną.
Badania obejmowały eksperyment składający się z trzech serii pomiarów (I, II i III), dotyczących wpływu wieku na właściwości fizjologiczne i mechaniczne mięśni, obejmujące zmiany szybkości narastania siły, relaksacji mięśni kończyn górnych oraz mocy kończyn dolnych, u mężczyzn w różnym wieku.
Celem I. serii było określenie wpływu wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego, związaną ze zmianą kąta stawowego.
Celem II. serii było określenie wpływu wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
Celem III. serii było określenie wpływu wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
Seria I
Z wiekiem dochodzi do obniżenia poziomu siły mięśni zginaczy stawu łokciowego (mierzonej w warunkach izometrycznych) oraz do obniżenia szybkości jej narastania i relaksacji. Zmiany te w różnych kątach (a zatem przy różnej długości tych mięśni) mogą przebiegać odmiennie. Założono, że:
Do 60. roku życia następuje nieznaczny spadek poziomu rozwijanej siły oraz gradientów jej narastania i relaksacji, oznaczanych w warunkach izometrycznych. U osobników starszych zjawiska te występują z większym nasileniem.
W dużych mięśniach, faza początkowego narastania oraz początkowej relaksacji zależy głównie od typu i ilości pobudzonych jednostek motorycznych oraz od szybkości przyłączania jonów Ca2+ do TnC, dlatego wyższe wartości gradientów wczesnego i połowy narastania lub wczesnej i połowy relaksacji powinny cechować młodsze grupy. W fazach późnej i końcowej, gradienty narastania i relaksacji wykazują mniejsze różnice. Wynikają one z przebiegu zmian morfologicznych zachodzących w mięśniach osób starszych i ze zmniejszania się częstotliwości pobudzania motoneuronów obu typów.
W wyniku zmian morfologicznych i czynnościowych zachodzących w mięśniach i ośrodkowym układzie nerwowym osoby starsze mogą uzyskiwać szybciej maksymalne pobudzenie, mając mniejszą liczbę włókien oraz niższą częstotliwość pobudzeń przy niższym progu pobudliwości jednostek motorycznych. Dlatego z wiekiem należy spodziewać się skrócenia czasu końcowego narastania siły.
Spadek poziomu MVC i zmniejszenie szybkości narastania siły, przy zmniejszonej elastyczności mięśni nie powinno w istotny sposób, w porównaniu z osobami młodszymi, wpływać na zależność pomiędzy siłą a długością mięśni, wywołaną zmianą kąta w stawie.
Seria II
Przebieg narastania siły i relaksacji dla zginaczy stawu łokciowego, w kącie 90o, powinien wykazywać wyraźniejsze zróżnicowanie pomiędzy osobami w różnym wieku, przy uwzględnieniu wartości maksymalnego gradientu narastania (MGN), a tym samym różnego odsetkowego udziału włókien ST i FT. W szczególności należy spodziewać się, że:
W fazie wczesnego narastania siły i 50% narastania siły, osoby starsze powinny uzyskać niższe wartości gradientów narastania. W fazie końcowego narastania starsi badani obu grup ("szybkich" i "wolnych") mogą uzyskać nieco większe gradienty od osób młodszych.
Niezależnie od wartości MGN, badani starszych grup powinni uzyskać dłuższe czasy wczesnego narastania i połowy czasu narastania, a krótszy czas końcowego narastania.
Wskutek obniżenia częstotliwości pobudzania włókien mięśniowych, zwłaszcza włókien ST, u osób o niskim maksymalnym gradiencie narastania siły, w porównaniu z osobami o wysokim gradiencie, z wiekiem we wszystkich fazach występuje większe zwolnienie przebiegu relaksacji.
Ze względu na większą szybkość derekrutacji, zmniejszoną częstotliwość pobudzania oraz w związku ze zmianą cech mechanicznych obu typów włókien mięśniowych, starsi badani powinni uzyskać wydłużone czasy wszystkich faz relaksacji.
Seria III
Moc mięśniowa jest ważnym wskaźnikiem sprawności układu mięśniowego, związanym z wykonywaniem ruchów z dużą dynamiką. Z dotychczasowych badań wynika, że z wiekiem cecha ta ulega obniżeniu. Zmiany szybkości skurczu i obniżenie siły mięśniowej powinny spowodować w konsekwencji:
Obniżenie maksymalnej mocy mięśniowej, w stopniu podobnym lub wyższym do spadku siły mięśniowej, wynikające ze zmiany własności fizjologicznych i mechanicznych mięśni.
Większy spadek składowej szybkościowej mocy (V0) niż jej składowej siłowej (szybkości granicznej, F0) z wiekiem może wynikać z pogorszenia się koordynacji nerwowo-mięśniowej oraz ze zmian w układzie kostno-stawowym u osób starszych.
Seria I. Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
Badaniom poddano 63 mężczyzn, w wieku od 20 do 76 lat. Badani zostali podzieleni na 4 grupy wiekowe:
St-20: mężczyźni w wieku od 20 do 25 lat (studenci wychowania fizycznego; 15 osób);
M-40: mężczyźni w wieku od 34 do 50 lat (16 osób);
M-50: mężczyźni w wieku od 51 do 60 lat (16 osób);
S-60: mężczyźni w wieku powyżej 60 lat (16 osób).
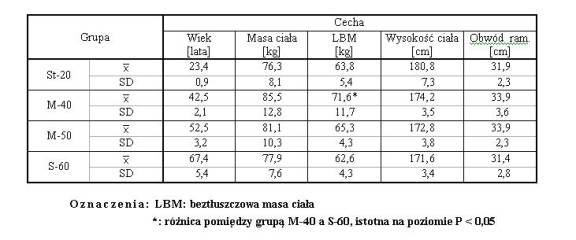
Przed przystąpieniem do badań, każdy z badanych udzielał szczegółowych informacji związanych z rodzajem pracy zawodowej oraz z własną aktywnością fizyczną. Z analizy tych danych wynika, że badani stanowili grupę zróżnicowaną pod względem wykonywanego zawodu oraz aktywności fizycznej. Część z nich uczestniczyła systematycznie (przynajmniej 2-krotnie w tygodniu) w dodatkowych, nie związanych z wykonywanym zawodem, formach aktywności fizycznej. Uprawiali głównie tenis ziemny, koszykówkę, piłkę siatkową, biegi, jazdę na rowerze i inne formy zajęć. W grupie M-40 było 9 takich osób, w M-50: 7, a w S-60: 3. W grupie St-20, ze względu na specyfikę studiów wychowania fizycznego, wszyscy badani brali udział w regularnych zajęciach sprawnościowych, wynikających z planu studiów. Charakterystykę biometryczną badanych grup przedstawiono w tabeli 2.1.
Tabela 2.1. Parametry biometryczne mężczyzn z czterech grup wiekowych: St-20 (n = 15), M-40 (n = 16), M-50 (n = 16) oraz S-60 (n = 16), w I. serii badań
 |
Seria II. Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
W badaniach uczestniczyło 76 osób podzielonych na 2 grupy wiekowe: grupa młodsza (Mł), licząca 46 osób w wieku od 21 do 24 lat, oraz grupa starsza (St) złożona z 30 osób w wieku od 51 do 76 lat. W każdej z tych grup wyodrębniono podgrupy osób o wysokim MGN ("szybcy"; Sz) oraz o niskim MGN ("wolni"; W).
grupa "szybka" młodsza (Sz-Mł) i "wolna" młodsza (W-Mł) liczyły po 15 osób;
grupa "szybka" starsza (Sz-St) i grupa "wolna" starsza (W-St) liczyły po 10 osób.
Jako kryterium podziału badanych na grupę o wysokich i niskich predyspozycjach szybkościowych, przyjęto maksymalny gradient narastania siły (MGN), osiągany podczas pomiaru siły w warunkach izometrycznych, zgodnie z procedurą opisaną w ko-lejnym rozdziale. Był on wyliczany dla każdego badanego w dwóch grupach: młodszej - studentów wychowania fizycznego oraz starszej, złożonej z mężczyzn, którzy przekroczyli 50. rok życia. Grupa młodsza liczyła 46 osób, a starsza - 30 osób. Wszystkich badanych w każdej z obu tych grup uszeregowano pod względem poziomu osiąganego maksymalnego gradientu narastania siły (MGN), od największej do najmniejszej wartości. Następnie do grupy "szybkich" zakwalifikowano około 33% tych badanych, którzy uzyskali najwyższe wartości MGN, a do grupy "wolnych" osoby, które osiągnęły najniższe gradienty (również około 33% z każdej grupy). Wyniki pozostałych badanych, którzy uzyskali pośrednie wartości gradientu, zostały odrzucone. W grupie "szybkiej" młodszej (Sz-Mł) i "wolnej" młodszej (W-Mł) znalazło się po 15 osób, a obie starsze grupy (Sz-St i W-St) liczyły po 10 osób. Charakterystykę biometryczną badanych zawiera tabela 2.2.
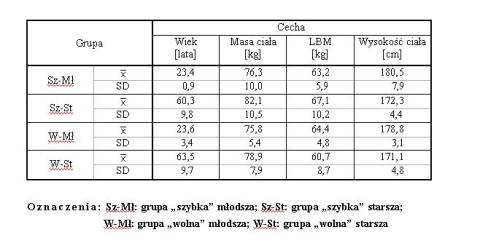
Charakterystyka biometryczna mężczyzn z czterech grup: Sz-Mł (n=15), Sz-St (n=10), W-Mł (n=15) oraz W-St (n=10), w II. serii badań
Tabela 2.2. Charakterystyka biometryczna mężczyzn z czterech grup: Sz-Mł (n=15), Sz-St (n=10), W-Mł (n=15) oraz W-St (n=10), w II. serii badańPo tak dokonanym podziale na grupy "szybkie" i "wolne" dokonano analizy statystycznej uzyskanych wyników. Oceniano różnice oraz ich istotność, pomiędzy osobnikami "szybkimi" a "wolnymi" w różnych grupach wiekowych oraz różnice pomiędzy "szybkimi" a "wolnymi" w tych samych grupach wiekowych. Rozpatrywano różnice w zakresie poziomu osiąganych gradientów oraz czasów poszczególnych faz narastania siły pomiędzy odpowiednimi grupami badanych. Podobnie postępowano pod względem gradientów oraz czasów relaksacji.
 |
Seria III. Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
W badaniach uczestniczyło 62 mężczyzn podzielonych na 4 grupy wiekowe:
St-20: 25 osób w wieku od 20 do 24 lat;
M-40: 14 osób w wieku od 34 do 50 lat;
M-50: 15 osób w wieku od 51 do 56 lat;
S-60: 8 osób w wieku od 61 do 69 lat.
Udział w badaniach był całkowicie dobrowolny. Każdy z badanych został poinformowany o celach przeprowadzanego eksperymentu, charakterze prowadzonych tes-tów i stosowanych metodach pomiarowych. Ustalono zasadę, aby osoby objęte badaniami utrzymywały normalny dla nich poziom aktywności fizycznej i nie wykonywały żadnych ciężkich wysiłków w czasie 24 godzin poprzedzających badania. Badania wykonywano przed południem, w godzinach pomiędzy 800 a 1200. Przystępując do nich, badani nie mogli się znajdować pod wpływem środków wpływających na zdolność koncentracji lub szybkość reakcji (np. kofeina), farmakologicznych opóźniających czas reakcji (leki analeptyczne, środki znieczulające czy alkohol). Wszystkie osoby badane były zobowiązane przedstawić zaświadczenie lekarskie o braku przeciwwskazań do wy-konania zaplanowanych w eksperymencie wysiłków.
Przed przystąpieniem do badań każdego uczestnika poddano dwukrotnym pomiarom wysokości i masy ciała z dokładnością, odpowiednio, do 0,5 cm i 0,1 kg, a następnie wyliczano średnią arytmetyczną z dwóch pomiarów. Do pomiaru wysokości i masy ciała badani przystępowali w strojach sportowych i boso. Przed pierwszą sesją badawczą dokonano 3-krotnego pomiaru długości przedramienia (odległość między punktami: Radiale [r], leżącym na górnym brzegu główki kości promieniowej, przy swobodnie opuszczonej wzdłuż tułowia kończynie górnej, w pozycji nawrócenia, a Stylion [sty] - znajdującym się na szczycie wyrostka rylcowatego kości promieniowej), wyliczając z nich średnią arytmetyczną. W stosunku do długości przedramienia wyznaczono promień (R) przyłożenia siły podczas pomiarów MVC.
W każdej z badanych grup analizowano również beztłuszczową masę ciała (LBM). Pomiaru dokonywano metodą impedancji bioelektrycznej, zgodnie z metodyką pomiaru stosowaną przez RJL Systems Inc. (USA). Szczegółową charakterystykę badanych grup zawiera tabela 2.3.
Charakterystyka biometryczna mężczyzn z czterech grup wiekowych:
St-20 (n = 25), M-40 (n = 14), M-50 (n = 15) oraz S-60 (n = 8), w teście mocy fosfagenowej
Tabela 2.3. Charakterystyka biometryczna mężczyzn z czterech grup wiekowych: St-20 (n = 25), M-40 (n = 14), M-50 (n = 15) oraz S-60 (n = 8), w teście mocy fosfagenowej
 |
Założenia badawcze zostały zaakceptowane przez Terenową Komisję Etyki Badań Naukowych przy Akademii Medycznej w Poznaniu (Orzeczenie z dnia 3.11.1999).
Spis treści
Seria I. Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
Pomiary siły zginaczy stawu łokciowego (w płaszczyźnie poziomej) wykonywano 2-krotnie w trzech kątach: 60, 90 i 1200,na stanowisku do badań biomechanicznych "Biodyna", wykonanym w Instytucie Techniki Lotniczej i Mechaniki Stosowanej Politechniki Warszawskiej. Było ono specjalnie dostosowane do podjętych badań [Mianowski, 1996; Kędzior i wsp., 1987]. Konstrukcja mechaniczna stanowiska pomiarowego została przedstawiona na rycinie 1. Główne jego części to:
siedzisko (1) do mocowania i stabilizacji badanej osoby w pozycji siedzącej za pomocą tapicerowanego wałka (2) i pasów (3);
dynamometr (4) z dźwignią (5), mocowany na stojaku;
stojak o regulowanej wysokości (6) i umocowana na nim głowica (7), umożliwiająca odpowiednie do budowy badanej osoby ustawienie dźwigni. Stojak jest mocowany na sztywno do ramy w taki sposób, aby umożliwić dostosowanie osi obrotu dźwigni do osi obrotu w stawie łokciowym każdej z osób badanych.
Konstrukcja dźwigni umożliwia przemieszczanie obejmy (8), umieszczonej na jej ramieniu. Dzięki temu można w każdym przypadku ustawić obejmę w dowolnym odcinku przedramienia badanego i dokładnie wyznaczyć ramię siły mięśni zginaczy stawu łokciowego. Zakres regulacji elementów ruchomych stanowiska pozwala na dokonanie pomiarów u osób o zróżnicowanych cechach antropometrycznych. Kalibracji urządzenia dokonano przy dwóch długościach ramienia dźwigni z obciążnikami 5, 10, 25, 50 i 100 kg. W tym zakresie stwierdzono liniowy przebieg oznaczanych wartości obciążeń. Siła była mierzona za pomocą tensometrów o stałym czasie odpowiedzi, połączonych z komputerem, co pozwalało na rejestrację oraz analizę zapisu przebiegu zmian siły w czasie. Elektroniczny sygnał z tensometrów analizowany był z częstotliwością 1000 Hz na kanał, przy użyciu przetwornika analogowo-cyfrowego (A-D 774JE). Zakres pomiaru momentu siły wynosił 190 Nm. Program komputerowy określał początek wzrostu siły w momencie, gdy rozwijana siła przekroczyła poziom spoczynkowy o 5% MVC. Krzywa F-t analizowana była w 5 ms odcinkach czasowych.
Każdy z badanych został szczegółowo poinformowany o zasadach i warunkach przeprowadzanych pomiarów. W celu zapoznania się badanych z procedurą badawczą, stosowano próbne pomiary, których celem było opanowanie prawidłowego sposobu wykonania próby. Uczono szybkiego rozwijania siły, utrzymywania jej w czasie pomiaru na najwyższym poziomie i relaksowania na sygnały dźwiękowe. Jest to niezbędny warunek uzyskania rzetelnych pomiarów.
Podczas sesji badani wykonywali cztery pomiary maksymalnej siły izometrycznej w każdym kącie. Między pomiarami w tym samym kącie występowała 2-minutowa przerwa. Pomiędzy pomiarami w różnych kątach przerwa trwała 5 minut. Kolejność pomiarów w kątach w pierwszej jak i drugiej sesji była dla wszystkich badanych jednakowa. W pierwszym badaniu: 90° (tzw. długość optymalna Lo), 120° i 60°, a w drugim 120°, 60° i 90° (ryc. 3.2). Obie sesje badawcze odbywały się w odstępie nie dłuższym niż 5 dni.
Rysunek 3.2. Schematyczne przedstawienie pozycji badanego podczas pomiaru maksymalnej siły izometrycznej mięśni zginaczy stawu łokciowego, w płaszczyźnie poziomej, w trzech kątach stawowych: 60o, 90o i 120o
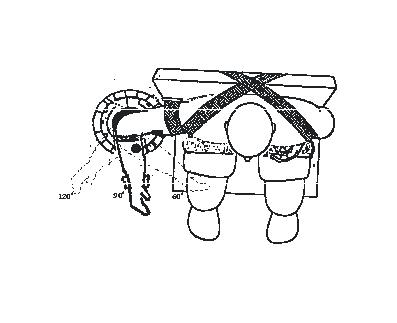
W czasie badań, w pomieszczeniu, w którym dokonywano pomiarów, przebywała tylko jedna osoba oraz dwóch, zawsze tych samych operatorów, którzy w czasie każdej próby znajdowali się poza polem widzenia badanego. Przed próbą badanych poddano standardowej rozgrzewce trwającej 5 minut. Pomiary przeprowadzano w pozycji siedzącej. Badany zajmował miejsce na fotelu, dotykając dokładnie plecami płaszczyzny podparcia. Części mechaniczne dźwigni były odpowiednio ustawione (zablokowane) do pomiaru w danym kącie. Badany umieszczał kończynę górną na dźwigni tak, aby oś obrotu w stawie łokciowym pokrywała się z osią obrotu ramienia dźwigni (oś obrotu w stawie łokciowym dla ruchów zginania i prostowania jest wyznaczona przez linię równoległą do linii łączącej nadkłykcie przyśrodkowy i boczny kości ramiennej i przesunięta o ok. 1 cm w kierunku obwodowym). Następnie dokonywany był pomiar długości ramienia dźwigni dla każdego badanego (od osi obrotu w stawie do punktu antropometrycznego Stylion [sty]). Przy określeniu długości ramienia dźwigni przyjęto zasadę, że początek obejmy u każdego badanego znajduje się na wysokości punktu Stylion, a koniec 4,5 cm w kierunku osi stawu łokciowego. Wszystkie pomiary skurczu izometrycznego podczas zginania w stawie łokciowym prawej kończyny górnej były wykonywane w pośrednim ułożeniu przedramienia (pomiędzy supinacją a pronacją), przy ramieniu ułożonym w pozycji odwodzenia w płaszczyźnie poziomej (ryc. 3.2). Przyjęto pośrednie ułożenie przedramienia, ponieważ z badań przeprowadzonych przez innych autorów [Rasch, 1995] wynika, że zarówno w kącie 90° jak i 100° największe wartości siły są rejestrowane w pośrednim położeniu przedramienia. Stabilizację tułowia podczas pomiarów zapewniano dzięki dwom biegnącym skrzyżnie pasom, które po ich napięciu dociskały tułów do oparcia. Poziomy wałek unieruchamiał uda w okolicy stawów biodrowych. Przedramię w okolicy stawu łokciowego stabilizował dodatkowy pasek, a od strony dłoni - uchwyt stabilizujący stawy nadgarstkowe. Stabilizacja badanego eliminowała działanie innych grup mięśniowych, warunkując rzetelność pomiarów.
Formuła "gotowe" oznaczała gotowość do reagowania przez badanego na odpowiednie sygnały dźwiękowe emitowane przez komputer. Pierwszy, słyszalny przez badanego dźwięk przyciskanego klawisza komputera traktowany był tylko jako stan gotowości, koncentracji uwagi i oczekiwania na sygnał rozpoczęcia pomiaru. Był on wybierany losowo w przedziale czasu od jednej do trzech sekund. Na ten sygnał badany starał się rozwijać największą siłę w najkrótszym czasie i utrzymywać ją do następnego sygnału. Na drugi, końcowy sygnał dźwiękowy z komputera badany miał dokonać natychmiastowej, najszybszej relaksacji. Aby uniknąć rutynowego wyprzedzania przez badanego reakcji na drugi sygnał, jego emisja odbywała się również losowo, po 2 lub 3 sekundach próby. Przed próbą każdemu z badanych wyjaśniano, na czym polega prawidłowe jej wykonanie oraz od czego zależą uzyskane parametry, wykorzystywane do oceny wydolności. Służyło to lepszemu umotywowaniu badanych i uzyskaniu pełnej mobilizacji w czasie wykonywania testu. Informowano o zauważonych w trakcie pomiaru spostrzeżeniach dotyczących wykonania poprzedniej próby. Kładziono nacisk, aby osoba badana wykonywała próbę zarówno z jak największą szybkością, jak i siłą, od początku do końca próby.
Z zapisu krzywej F-t wyznaczano i analizowano następujące parametry związane z jej narastaniem bądź relaksacją (ryc. 3.3):
Czas reakcji początkowej (tRP): czas od emisji sygnału zapoczątkowującego próbę do momentu osiągnięcia 5% MVC;
Gradient wczesnego narastania siły (GWN): największy przyrost siły, rejestrowany w [N], od 5% do 20% MVC;
Czas wczesnego narastania siły (tWN): czas wzrostu siły od 5% do 20% MVC, w [s];
Gradient połowy narastania MVC (G50%N): przyrost siły od 20% do 50% MVC, podzielony przez czas w którym ten przyrost nastąpił [N/s];
Połowa czasu narastania siły (PtN): czas wzrostu siły od 5% do 50% MVC [s];
Gradient późnego narastania (GPN): przyrost siły od 50% do 80% MVC, podzielony przez czas w którym ten przyrost nastąpił [N/s];
Czas późnego narastania (tPN): czas wzrostu siły od 50% do 80% MVC [s];
Gradient końcowego narastania (GKN): przyrost siły od 80% do 100% MVC, podzielony przez czas w którym ten przyrost nastąpił [N/s];
Czas końcowego narastania (tKN): czas wzrostu siły od 80% do 100% MVC [s];
Gradient wczesnej relaksacji (GWR): spadek siły rejestrowany od 95% do 80% siły końcowej, podzielony przez czas w którym ten spadek nastąpił [N/s];
Czas wczesnej relaksacji (tWR): czas spadku siły od 95% do 80% [s];
Gradient połowy relaksacji (G50%R): spadek siły rejestrowany od 80% do 50% siły końcowej, podzielony przez czas w którym ten spadek nastąpił [N/s];
Czas połowy relaksacji (PtR): czas opadania siły od 95% do 50% siły końcowej [s];
Gradient późnej relaksacji (GPR): spadek siły rejestrowany od 50% do 20% siły końcowej, podzielony przez czas w którym ten spadek nastąpił [N/s];
Czas późnej relaksacji (tPR): czas spadku siły od 50% do 20% [s];
Gradient końcowej relaksacji (GKR): spadek siły rejestrowany od 20% do 5% siły końcowej, podzielony przez czas w którym ten spadek nastąpił [N/s];
Czas końcowej relaksacji (tKR): czas spadku siły od 20% do 5% [s];
Maksymalny gradient narastania siły (MGN) wyznaczany jako największe nachylenie wzrostu siły mięśnia w odcinku czasu równym 5 ms [N/s];
Maksymalny gradient relaksacji (MGR) wyznaczany jako największe nachylenie spadku siły mięśnia w odcinku czasu równym 5 ms [N/s].
Rysunek 3.3. Stanowisko do badania siły mięśni zginaczy stawu łokciowego ("Biodyna"): 1 - faza reakcji początkowej; 2 - faza wczesnego narastania; 3 - faza połowy narastania; 4 - faza późnego narastania; 5 - faza końcowego narastania; 6 - faza reakcji końcowej; 7 - faza wczesnej relaksacji; 8 - faza połowy relaksacji; 9 - faza późnej relaksacji; 10 - faza końcowej relaksacji; SP - sygnał początkowy; SK - sygnał końcowy; MVC - maksymalna dowolna siła izometryczna; PtN - połowa czasu narastania siły; PtR - połowa czasu relaksacji
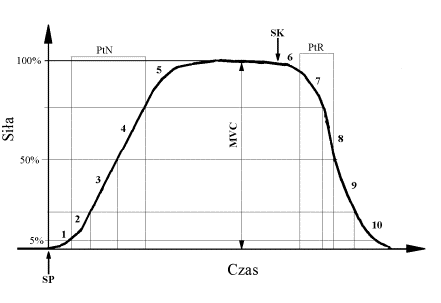
Ze względu na wprowadzenie do badań nowej metodyki oznaczania parametrów narastania i relaksacji siły mięśniowej, przeprowadzono badania powtarzalności uzyskanych wyników, które polegały na wykonaniu dwóch testów przeprowadzonych w krótkim odstępie czasu, w tych samych warunkach i przez tych samych badanych [Baumgarten i Jackson, 1987]. Do oceny powtarzalności zastosowano tzw. wew-nątrzklasowy współczynnik korelacji (ICC). Był on wyliczany dla całej grupy osób uczestniczących w badaniach, oddzielnie dla każdego analizowanego parametru. Uprzednio wykonane badania z udziałem studentów wychowania fizycznego [Jaskólski i wsp., 1999] wykazały wysoką powtarzalność zastosowanej metody, jednak udział w badaniach osób w tak zróżnicowanym wieku wymagał określenia powtarzalności dla całej badanej grupy.
Seria II. Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
Pomiaru parametrów charakteryzujących narastanie siły i relaksację w kącie 90° dokonano na stanowisku oraz według metodyki pomiaru opisanej w rozdziale dotyczącym I. serii eksperymentu.
Seria III. Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
Próba była wykonywana na ergometrze Monark (model 818E), specjalnie przystosowanym do ciągłej, komputerowej (PC AT) rejestracji przebiegu próby. Analizowano podstawowe wielkości fizyczne, którymi były: siła oporu przyłożonego do koła zamachowego ergometru oraz czas między kolejnymi przejściami strumienia światła fotokomórki przez 2 spośród 12 otworów umieszczonych równomiernie na obwodzie tarczy pedałów. Czas ten dawał podstawę do wyznaczenia aktualnej liczby obrotów pedałów w ciągu minuty. Jednocześnie, za pomocą czujnika tensometrycznego (CAS, typ BC-15A; dokładność systemu: czujnik-przetwornik: ±10g),do którego przymocowana była taśma hamująca koło zamachowe, rejestrowano siłę oporu (F). Częstotliwość próbkowania wynosiła 60 Hz. Szybkość obrotów oraz siła oporu były podstawą do wyznaczania rozwijanej mocy, uśrednianej co 0.1 s. Pomiar rozpoczynał się automatycznie, gdy (po usłyszeniu sygnału gotowości sprzętu) badany wykonał ruch pedałami, w momencie przejścia światła fotokomórki przez pierwszy z otworów.
W celu lepszej stabilizacji ergometr ustawiany był przed specjalnym rusztowaniem, zaopatrzonym w uchwyty, które stanowiły pewne oparcie dla osoby wykonującej próbę, zastępując kierownicę.
Próbę przeprowadzono na podstawie metodyki opracowanej przez Vandewalle i wsp. [1985], wykorzystując zależności pomiędzy zastosowaną siłą oporu a częstotliwością obrotów w zakresie od 100 do 200 obr/min [Vandewalle i wsp., 1987]. Po standardowej rozgrzewce badany wykonywał krótki, 6-8 sekundowy wysiłek na ergometrze rowerowym, pokonując zastosowaną, każdorazowo inną, siłę oporu na kole ergometru. Próba obejmowała minimum 5 wysiłków. Badany musiał za każdym razem osiągnąć największą częstotliwość obrotów. W tym celu stosowano doping słowny. Wysiłek przerywano, gdy zmniejszała się częstotliwość obrotów.
Pierwsza wartość siły oporu na kole ergometru wynosiła 7% masy ciała i w kolejnych wysiłkach była zwiększana o 1%. Każdy kolejny wysiłek był wykonywany po około 5-minutowym odpoczynku. Próbę kontynuowano do momentu, gdy w kolejnym wysiłku badany nie był w stanie osiągnąć częstotliwości 100 obrotów/min.
Na podstawie uzyskanych wartości obrotów/min przy odpowiadającej im sile oporu, wyznaczano graniczną liczbę obrotów i graniczną siłę oporu, korzystając z równania regresji liniowej:
y = - ax + b
gdzie: y - graniczna liczba obrotów/min (V0); a - współczynnik nachylenia prostej; x - zastosowana wartość siły oporu (F); b - przesunięcie względem osi y.
Ponieważ największą moc - Pmax osiąga się przy wartości oporu równej 0.5F0 (F0: tzw. graniczna wartość siły oporu, czyli pierwszego z rosnących oporów, przy którym badany nie byłby już w stanie wykonać żadnego obrotu kołem ergometru) i odpowiadającej jej częstotliwości obrotów 0.5V0 (V0 - liczba obrotów uzyskanych, gdy zastosowana wartość siły oporu wyniosłaby 0; ryc. 3.4), to:
Pmax [W] = 0.25 F0 [N] x V0 [m/s]
Oceny mocy fosfagenowej dokonuje się na podstawie wyliczonej mocy maksymalnej (Pmax) oraz tzw. granicznych wartości siły oporu (F0) i częstotliwości obrotów (V0). Są to parametry wskazujące na indywidualne możliwości siłowo-szybkościowe badanych.
Uzyskane wyniki zostały opracowane statystycznie. Podstawowe wyliczenia obejmowały średnie arytmetyczne oraz odchylenia standardowe średniej. W przypadku pomiarów wykonywanych na stanowisku biomechanicznym, dla każdego z parametrów wyliczano średnią arytmetyczną. Była ona wyliczana jako średnia z czterech pomiarów dla każdej z dwóch sesji pomiarowych. Średnia uwzględniana w obliczeniach statystycznych stanowiła średnią z dwóch sesji pomiarowych dla każdego z parametrów.
W zależności od celu stosowano analizę wariancji jednoczynnikowej ANOVA lub analizę wariancji wieloczynnikowej MANOVA. W celu porównania pomiarów w kolejnych kątach oraz pomiędzy grupami zastosowano analizę wariancji wieloczynnikowej MANOVA, dla sparowanych danych uzyskanych przez tych samych badanych. Gdy MANOVA wykazała istnienie różnic statystycznie istotnych (p<= 0,05), to poziom istotności oceniano za pomocą metody kontrastów, oznaczając ją dla poszczególnych par kątów. Metodę analizy jednoczynnikowej ANOVA zastosowano dla oznaczenia istotności różnic pomiędzy poszczególnymi grupami. Tą metodą wyznaczano różnice pomiędzy poszczególnymi parametrami, w II. oraz III. serii eksperymentu. Poziom istotności różnic wyznaczano, wykorzystując test Tukey [Baumgarten i Jackson, 1987; Parker, 1978]. Różnice istotne statystycznie przyjęto, gdy p<=0,01 lub p<=0,05.
Związek pomiędzy wybranymi parametrami oceniano, wyznaczając współczynnik korelacji prostej dla tych parametrów, a poziom istotności związku oceniano testem "t" Studenta.
Spis treści
- 4.1. Seria I: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
- 4.2. Seria II: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
- 4.3. Seria III: Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
Podstawowe parametry somatyczne nie różnicują statystycznie badanych grup. Szczegółowa charakterystyka tych parametrów wraz z udziałem tkanki aktywnej oraz obwodami ramienia zawarta jest w tabeli 2.1. Jednakże istotne różnice (p<=0,05) występują tylko pomiędzy grupą M-40 a S-60 i dotyczą beztłuszczowej masy ciała (LBM). Pod względem pozostałych cech różnice nie są istotne statystycznie (p>0,05). Analizując wpływ wieku na poziom tych parametrów (przez wyliczenie współczynnika korelacji prostej wszystkich badanych), stwierdzono, że tylko w przypadku LBM (w kg) jest on statystycznie istotny i wynosi -0,44 (p<=0,05).
Badania powtarzalności wszystkich rejestrowanych parametrów wskazują na dużą dokładność uzyskanych wyników, chociaż stwierdza się bardzo znaczne, indywidualne wahania w każdej grupie wiekowej. Wysokie wartości wskaźnika ICC potwierdzają wcześniej uzyskane w tutejszym laboratorium wyniki, w badaniach wykonanych na grupie studentów [Jaskólski i wsp., 1999]. Dotyczy to również gradientów narastania maksymalnej dowolnej siły i jej relaksacji, tj. parametrów, których pomiar wymaga zachowania szczególnie dużej dokładności postępowania. Wysoką powtarzalność wyników uzyskano we wszystkich kątach pomiarowych, na co wskazują wysokie wartości wskaźnika powtarzalności wyników (ICC). Najniższa jego wartość przekraczała 0,80, będąc każdorazowo istotną statystycznie (p<=0,05, tab. 4.1).
W badaniach maksymalnej siły izometrycznej, w odniesieniu do której wyznaczano szereg pozostałych parametrów, występuje regularnie powtarzająca się we wszystkich kątach tendencja, wskazująca, że najwyższą MVC, w kątach 60°, 90° i 120° uzyskują badani z grupy M-40, a najniższą, najstarsi badani (S-60) (tab. 4.2 A,B,C).
Tabela 4.1. Wartości wewnątrzklasowego współczynnika korelacji (ICC), dla parametrów fazy narastania siły i relaksacji, dla wszystkich badanych
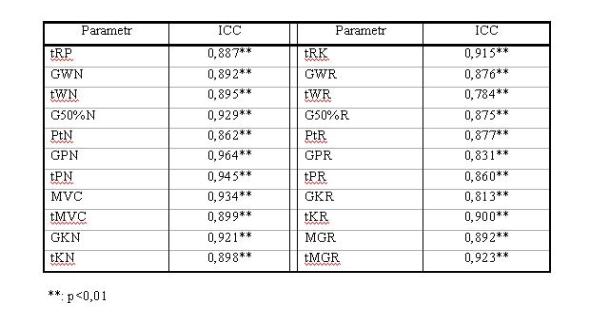 |
Tabela 4.2. Maksymalna dowolna siła izometryczna (MVC), maksymalny gradient narastania siły (MGN), maksymalny gradient relaksacji (MGR) i czasy ich osiągania, w kącie 60o (A), 90o (B) oraz 120o (C), w czterech badanych grupach wiekowych
 |
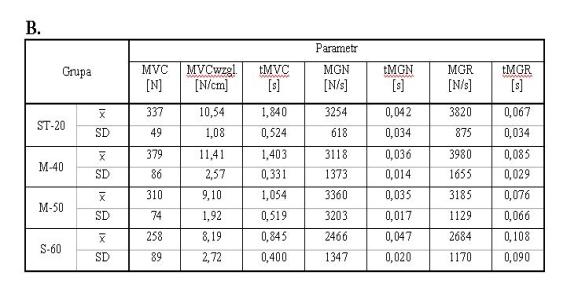

W grupie St-20 oraz M-50, siła we wszystkich kątach jest podobna i w kącie 60° osiąga wartości: od 242 ( 71 N do 337 ( 49 N. Tylko pomiędzy grupami M-40 i S-60 istotne różnice (istotne na poziomie p<=0,01 lub p<=0,05) występują we wszystkich kątach. W kątach 60° i 90° stwierdzono różnice pomiędzy grupami St-20 i S-60 (p<=0,05). W kącie 60° wystąpiła także różnica pomiędzy grupami M-40 a M-50 (p<=0,05; tab. 4.3A).
Najwyższe wartości MVC we wszystkich grupach wystąpiły w kącie 90°, a naj-niższe w kącie 60°. Badani z grupy M-40 uzyskali jednak w tym kącie wyniki niewiele mniejsze od osiąganych w kącie 120°, tj. 96% wartości, podczas gdy w pozostałych grupach, w stosunku do 120°, siła osiągnęła poziom: M-50: 82%, S-60: 81% a St-20: 88% (ryc. 4.1).
Tabela 4.3. Istotne różnice MVC i gradientów (A) w kątach 60o, 90o lub 120o oraz czasu trwania (B) poszczególnych faz narastania siły i relaksacji, pomiędzy badanymi grupami
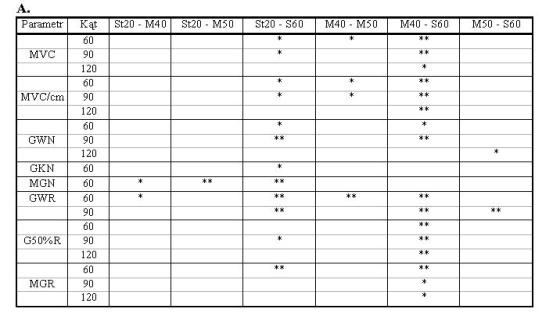 |
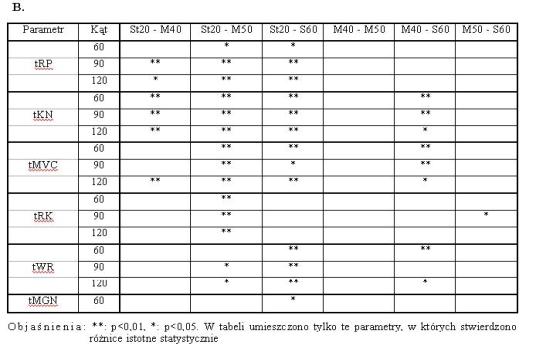
Rysunek 4.1. Wartości maksymalnej, dowolnej siły izometrycznej zginaczy stawu łokciowego oraz różnice pomiędzy trzema kątami pomiarowymi, w badanych grupach
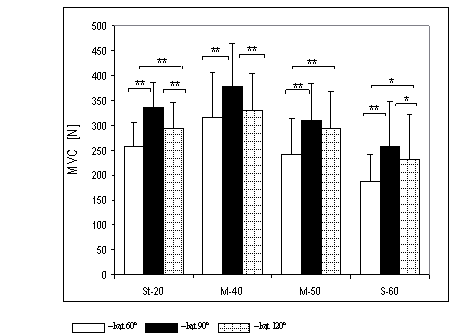
Oznaczenia: ** - różnica istotna na poziomie p<0,01;
* - różnica istotna na poziomie p<0,05
Podobnie przedstawiały się wyniki uwzględniające obwód ramienia (tab. 4.2 A,B, C). Wykresy MVC (wyrażane w N) oraz MVC przeliczane na obwód ramienia (wyrażane w N/cm) mają niemal identyczną postać oraz jednakowe różnice pomiędzy poszczególnymi kątami w każdej z grup (ryc. 4.2). Także różnice wartości średnich pomiędzy grupami są prawie takie same jak w przypadku MVC wyrażanego w N (tab. 4.3A).
Stwierdzono, że przeciętny poziom MVC jest istotnie związany z wiekiem badanych, wykazując z nim istotną, ujemną korelację. Wyliczony dla badanych (jako średnia z trzech kątów) współczynnik korelacji wyniósł -0,37; p<=0,05, co wskazuje na znaczące obniżenie MVC wraz z wiekiem (ryc. 4.3).
Pomiędzy grupami wykazano istotne różnice w zakresie czasu osiągania MVC (tab. 4.2A,B,C; tab. 4.3B). Studenci, którzy w każdym z kątów uzyskiwali najdłuższe czasy, osiągali znacząco dłuższy tMVC w porównaniu z pozostałymi grupami: M-40, M-50 i S-60. Największe różnice - pomiędzy grupą St-20 a trzema pozostałymi grupami (p<=0,01; tab. 4.3B) oraz pomiędzy grupą S-60 a M-40 (p<=0,05) - miały miejsce w największym kącie (120°). W najmniejszym kącie, 60o istotna różnica wystąpiła pomiędzy najstarszymi grupami (S-60 i M-50) a St-20 oraz S-60 a M-40 (p<=0,01). W kącie 90o,pomiędzy grupą S-60 a M-40 i M-50 a St-20 (p<=0,01), a pomiędzy St-20 a S-60: p<=0,05.
Rysunek 4.2. Wartości maksymalnej, dowolnej siły izometrycznej wyrażanej na cm obwodu ramienia oraz różnice pomiędzy trzema kątami pomiarowymi w badanych grupach. Oznaczenia jak na ryc. 4.1.
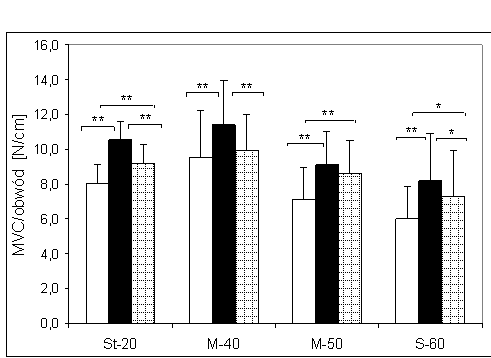
Rysunek 4.3. Zależność pomiędzy MVC (średnia z trzech kątów) a wiekiem badanych mężczyzn *: zależność istotna na poziomie p<0,05
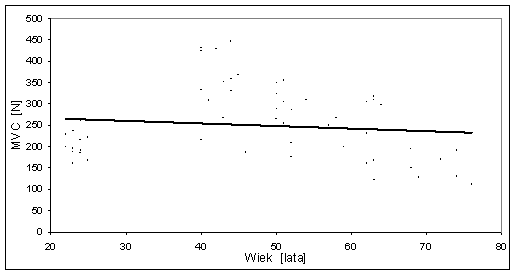
Niewielki był wpływ kąta stawowego na kształtowanie się tego parametru w każdej z grup. Znaczące różnice stwierdzono jedynie w grupie M-50. tMVC w kącie 120° był najkrótszy i różnił się istotnie zarówno od czasu uzyskanego w kącie 60° (p<=0,01), jak i w kącie 90° (p<=0,05; ryc. 4.4). W pozostałych grupach nie stwierdzono istotnych statystycznie różnic w kolejnych kątach stawowych (p>0,05).
Dynamika narastania siły w czasie, charakteryzowana jest przez osiągany maksymalny gradient narastania siły oraz gradienty poszczególnych jej faz. Największe wartości maksymalnego gradientu osiągali St-20 (tab. 4.2A,B,C). Najmniejsze gradienty w każdym z kątów stwierdzono u najstarszych badanych (S-60). W pozostałych dwu grupach gradient wahał się od 2623 do 3360 N/s. Znaczące różnice MGN wystąpiły wyłącznie w najmniejszym kącie: 60° i wynikały z osiągania zdecydowanie największego gradientu przez badanych z grupy St-20. Tylko pomiędzy grupą studentów a ba-danymi pozostałych grup wystąpiła istotna różnica (p<=0,01, tab. 4.3A). W większych kątach - wraz z wydłużaniem się badanych mięśni - pomiędzy poszczególnymi grupami występowały znacznie mniejsze, nieistotne różnice tego parametru (p>0,05).
Analiza wartości gradientów uzyskanych w każdej z grup w trzech kątach wykazała, że kąt stawowy ma istotny wpływ na wielkość MGN. W grupie St-20 gradient uzyskany w kącie 60° jest istotnie większy od osiąganych w obu pozostałych kątach (p<=0,01; ryc. 4.5). Natomiast w obu najstarszych grupach (S-60 i M-50) maksymalny gradient uzyskany w kącie 60° jest dla odmiany istotnie mniejszy od obu pozostałych: w kącie 90°, p<=0,01, a w kącie 120°, p<=0,05. W trzech grupach nie stwierdzono istotnych różnic MGN osiąganego w kątach 90° i 120°. Tylko w grupie M-40 była to różnica istotna na poziomie p<=0,05.
Rysunek 4.5. Maksymalny gradient narastania (MGN) oraz istotność różnic między kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
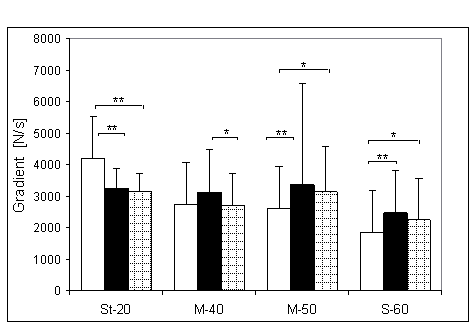
Wykazano również, że czas osiągania MGN nie różnicuje w istotny sposób badanych grup, wahając się w wąskim zakresie od 0,033 do 0,047 s (tab. 4.2A,B,C). Tylko w kącie 60° grupa St-20 uzyskała istotnie krótszy tMGN (0,023 +- 0,014 s) od najstarszej grupy (S-60: 0,040 +- 0,012 s) (p<=0,05; tab. 4.3B).
Porównanie tMGN każdej z grup uzyskanego w trzech kątach wykazało, że różnice pomiędzy trzema najstarszymi grupami nie są istotne (tab. 4.2A,B,C; ryc. 4.6). Tylko w grupie St-20 istotne różnice dotyczyły kątów 60° i 90°(p<=0,01) oraz 60o i 120° (p<=0,5).
Wykazano również istotne powiązanie MGN z wiekiem (ryc. 4.7). Istnieje ujemny związek tego parametru z wiekiem badanych (r = -0,42; p<=0,05), wskazujący na jego regresję w miarę starzenia się organizmu.
Rysunek 4.6. Czas osiągania MGN (tMGN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
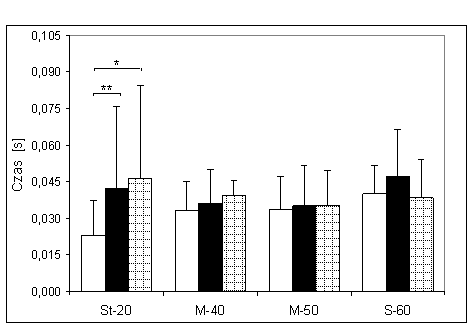
**: zależność istotna na poziomie p<0,01
Osiągnięty czas reakcji początkowej (tRP) wykazał istnienie statystycznie istotnych różnic pomiędzy grupą St-20 a pozostałymi grupami. Najkrótszy czas reakcji początkowej, we wszystkich kątach, wystąpił w grupie studentów (tab. 4.4A,B,C). Nieco dłuższy czas stwierdzono u badanych z grupy M-40. W obu najstarszych grupach: S-60 i M-50, tRP wahał się w wąskich granicach od 0,284 do 0,294 s.
Tabela 4.4. Parametry narastania siły w kącie 60o (A), 90o (B) i 120o (C), w czterech grupach wiekowych mężczyzn
 |


Różnica tRP w kącie 60° pomiędzy studentami a grupami M-50 i S-60 była istotna na poziomie p<=0,05 (tab. 4.3B). W obu kolejnych kątach różnice pomiędzy studentami a pozostałymi grupami były na poziomie p<=0,01. Wykazano jednocześnie, że tylko w najmłodszej grupie (St-20) czas uzyskany w kącie 60° i 90° oraz 60° i 120° różnił się istotnie (p<=0,01; ryc. 4.8). W innych grupach nie było znaczących różnic w poziomie czasów uzyskanych w różnych kątach.
W fazie wczesnego narastania siły największe wartości gradientu osiągali badani z dwu młodszych grup (St-20 oraz M-40), (tab. 4.4A,B,C). Badani z grupy M-50, a zwłaszcza najstarsi (S-60), osiągali (z wyjątkiem kąta 90°) znacznie niższe gradienty. Gradienty uzyskane przez grupy St-20 i M-40 były około 2-krotnie wyższe od osiąganych przez badanych z grupy S-60. W kącie 60° były to różnice na poziomie p<=0,05 (tab. 4.3A), a w kącie 90° pomiędzy tymi samymi grupami różnice osiągnęły poziom p<=0,01. W największym kącie, także badani z grupy M-50 mieli od najstarszych (S-60) istotnie wyższy GWN (p<=0,05).
Wystąpiły również różnice gradientów uwarunkowane kątem pomiarowym. W każdej z grup stwierdzono różnice pomiędzy kątem 90° a 60° (p<=0,01 lub p<=0,05), a w grupach St-20 i M-40 również pomiędzy kątami 90° a 120°. Istotna różnica gradientu wczesnego narastania w kątach 60° i 120° miała natomiast miejsce w obu starszych grupach: M-50 i S-60 (p<=0,05; ryc. 4.9).
Rysunek 4.9. Wartości gradientu wczesnego narastania (GWN) oraz istotność różnic pomiędzy trzema kątami pomiarowymi w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
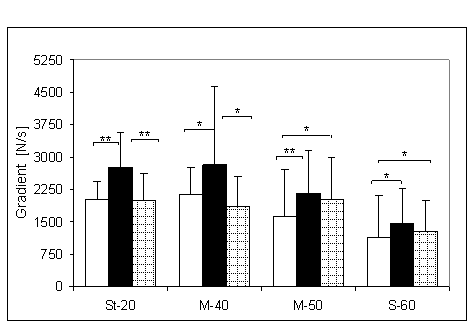
W żadnym z kątów nie stwierdzono istotnych statystycznie różnic pod względem czasu wczesnego narastania siły pomiędzy poszczególnymi grupami (p>0,05). Wartości tWN w trzech najstarszych grupach były bardzo podobne, wahając się od 0,035 do 0,045 s, tylko w kącie 120°, w grupie M-50 zarejestrowano znacznie krótszy czas (tab. 4.4A,B,C). Najkrótsze czasy w każdym z kątów osiągali badani z grupy St-20, ale różnice pomiędzy wartościami tWN osiągniętymi w różnych kątach były istotne tylko w najmłodszej grupie (St-20), pomiędzy kątami 90° a 120° (p<=0,05; ryc. 4.10).
W trzech młodszych grupach osiągane gradienty mają w każdym kącie zbliżone, nie różniące się statystycznie wartości (p>0,05; tab. 4.4A,B,C). W kącie 60°wahały się one od 1993 N/s do 2244 N/s, w kącie 90°: od 2830 do 2983N/s, a w kącie 120°: od 2114 N/s do 2871 N/s. W najstarszej grupie: S-60 stwierdzono znacznie niższe wartości G50%N, jednakże ze względu na duże indywidualne zróżnicowanie wyników, pomiędzy tą grupą a pozostałymi nie były to różnice statystycznie istotne.
W każdej z grup występują statystycznie istotne różnice gradientów połowy narastania pomiędzy kątami 60o i 90o (ryc. 4.11). W obu młodszych grupach istotnie różnią się gradienty w kątach 90° i 120° (p<=0,01), a w starszych: gradienty w kątach 60° i 120°. Wynika to z uzyskania przez badanych starszych grup, w największym kącie, znacznie większych gradientów (w stosunku do dwu pozostałych kątów), podczas gdy młodsi badani zdecydowanie największe gradienty osiągali w kącie prostym.
Połowa czasu narastania (PtN) pomiędzy grupami nie różnicowała istotnie w żadnym z kątów badanych grup (p>0,05). Nie wykazano też istnienia różnic w zależności od kąta w dwu najstarszych grupach (również p>0,05).W obu młodszych grupach takie różnice istnieją; w St-20 różnica w poziomie gradientu pomiędzy kątami 60° i 120° oraz 90° i 120° była istotna (p<=0,05) (tab. 4.4A,B,C; ryc. 4.12), podobnie jak w grupie M-40, dla kątów 90° i 120°. We wszystkich kątach najkrótsze czasy osiągali badani najmłodszej grupy: St-20. Uzyskane wartości indywidualne wykazywały (poza grupą studentów) wysokie wahania tego parameteru.
Wartości gradientów osiąganych w kolejnej, późnej fazie narastania także nie różnicują istotnie poszczególnych grup, w żadnym z kątów. Są one 2-3-krotnie mniejsze od G50%N, jednak w porównaniu z obiema starszymi grupami: M-50 i S-60, zauważa się, iż we wszystkich kątach badani obu młodszych grup uzyskują znacznie mniejsze gradienty (o około 50%) (tab. 4.4A,B,C; ryc. 4.13). Najniższe wartości GPN w niemal wszystkich kątach uzyskali najmłodsi badani (St-20), a tylko nieznacznie wyższe, badani z grupy M-40. Gradient późnego narastania siły, w większym stopniu niż inne parametry, różnicuje badanych, także w obrębie poszczególnych grup. Jednocześnie wykazano istnienie pewnych różnic jego wartości w zależności od kąta w stawowego. Nie występują one systematycznie w tych samych kątach w każdej z grup. W grupie St-20 różnice dotyczą kątów: 60° i 90° (p<=0,01) oraz 90° i 120° (p<=0,05), w grupie M-50: kątów 60° i 120°, a w najstarszej: S-60, gradient w kącie 90o był istotnie większy zarówno od uzyskanego w kącie 60°, jak też w kącie 120° (p<=0,05).
Rysunek 4.13. Gradient późnego narastania (GPN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
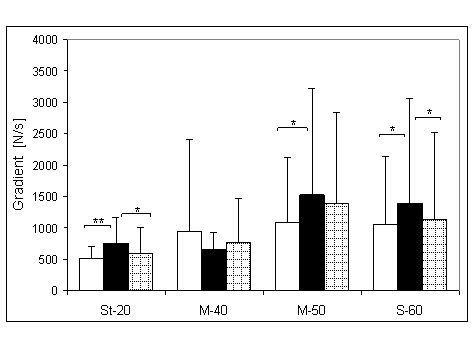
Także czasy trwania fazy późnego narastania (tPN) poszczególnych grup nie różniły się istotnie, co wskazuje, że wiek badanych nie wywiera istotnego wpływu na jego wartości. Jednakże najkrótszy tPN we wszystkich kątach osiągali badani M-50 (tab. 4.4A,B,C). tPN, uzyskiwany w trzech kątach pomiarowych, również nie wykazuje regularnie występujących, istotnych statystycznie różnic w poszczególnych grupach. Tylko w grupie studentów (St-20) stwierdzono istotną różnicę (p<=0,05) tPN pomiędzy kątami 120° a 90° i 120° a 60°, a w najstarszej grupie (S-60) różnica na tym samym poziomie wystąpiła dla kątów 60° i 90° (ryc. 4.14).
W fazie końcowego narastania tempa narastania siły było najmniejsze. Uzyskane gradienty końcowego narastania osiągają wartości od 44 do 102 N/s (tab. 4.4A,B,C). Również różnice pomiędzy poszczególnymi badanymi nie wykazują tak dużej rozpiętości, jak w poprzednich fazach. Zaznacza się tendencja do zwiększania się gradientu tej fazy narastania z wiekiem. We wszystkich kątach największe wartości gradientu końcowego narastania (GKN) mieli badani z grupy S-60, a najniższe wartości stwierdzono w grupie St-20. Jednakże, istotne różnice średnich wykazano tylko pomiędzy najstarszą (S-60) a najmłodszą grupą (St-20) (p<=0,05; tab. 4.3A). Znacznie większe różnice wynikają ze zmiany kąta pomiarowego (ryc. 4.15). Najmniejsze notuje się w grupie St-20, gdyż tylko pomiędzy kątami 60° a 90° jest ona istotna (p<=0,05). W pozostałych grupach istotne różnice GKN (p<=0,05 lub p<=0,01) występują pomiędzy wszystkimi kątami z wyjątkiem grupy S-60, w której GKN dla kątów 60° i 90° nie różnił się istotnie (p>0,05).
Rysunek 4.15. Gradient końcowego narastania (GKN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
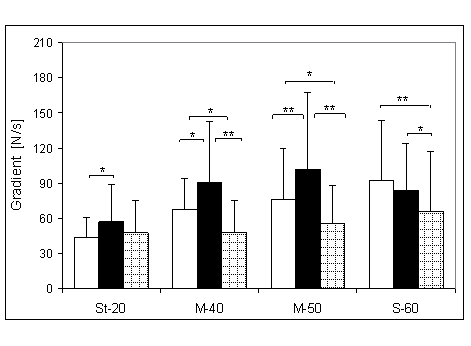
Czas końcowego narastania wykazuje istnienie wyraźnej i bardzo regularnej tendencji związanej z wiekiem badanych. Najkrótszy czas w każdym kącie osiągali najstarsi badani (S-60), a najdłuższy czas tej fazy narastania - najmłodsi (St-20). Badani pozostałych grup (M-40 i M-50) osiągnęli pośrednie wartości tKN (tab. 4.4A,B,C).
Czas końcowego narastania, w każdym z trzech kątów, w grupie St-20 był istotnie dłuższy (p<=0,01) od uzyskanego w trzech pozostałych grupach (tab. 4.3B). Podobnie wysokie różnice wystąpiły dla grup S-60 i M-40. Nie zanotowano natomiast istotnych różnic tKN w zależności od kąta. Tylko w grupie M-50, pomiędzy kątami 60° i 120°, wystąpiła istotna statystycznie różnica (p<=0,05; ryc. 4.16).
Spośród wszystkich gradientów narastania siły, pomiędzy wiekiem a gradientem, zależność istotną: r = -0,47 (p<=0,01) wykazano z GWN oraz r = -0,37 (p<=0,05), dla G50%N (tab. 4.5). W pozostałych przypadkach nie stwierdzono istotnego statystycznie związku (p>0,05). Tak więc, w późniejszych fazach narastania nie występuje znaczące, uwarunkowane wiekiem zmniejszanie się gradientów narastania siły. Odmiennie przedstawia się zależność pomiędzy wiekiem a czasem narastania poszczególnych faz. Nie ma istotnego związku między nimi w przypadku tWN, PtN oraz tPN. Istotna, ujemna zależność (p<=0,01) w każdym z kątów miała miejsce wyłącznie w przypadku tKN oraz tMVC, co oznacza skrócenie czasu trwania tej fazy z wiekiem.
Rysunek 4.16. Czas końcowego narastania (tKN) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
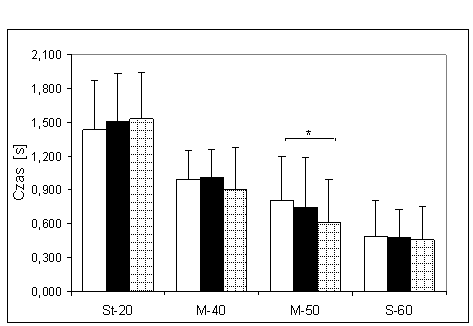
Tabela 4.5. Istotne statystycznie współczynniki korelacji pomiędzy wiekiem badanych a gradientami i czasami narastania siły oraz relaksacji (średnia z trzech kątów: 60o, 90o i 120o) kolejnych faz
 |
* - p<0,05; ** - p<0,01. Pozostałe korelacje są nieistotne.
Najkrótszy czas reakcji końcowej stwierdzono w grupie St-20, a najdłuższy tRK wystąpił w grupie M-50 (tab. 4.6A,B,C). W obu pozostałych grupach (M-40 i S-60) średnie tRK były bardzo podobne i wynosiły od 0,243 do 0,268 s. Istotne różnice pomiędzy grupami występują w każdym kącie stawowym pomiędzy grupą M-50 a St-20 (p<=0,01) oraz w kącie 90° pomiędzy grupą M-50 a S-60 (p<=0,05). Pomiędzy pozostałymi trzema grupami różnice nie były istotne (p>0,05; tab. 4.3B). W najstarszej i najmłodszej grupie nie stwierdzono statystycznie istotnych różnic tego parametru uzyskanego w poszczególnych kątach (ryc. 4.17). W grupie M-50 różnica średnich w kątach 60° i 120° oraz 90° i 120° jest statystycznie istotna (p<=0,05 lub p<=0,01), podobnie jak w grupie M-40 dla kątów 90° i 120° (p<=0,05).
Tabela 4.6. Parametry relaksacji w kącie 60o (A), 90o (B) i 120o (C), w czterech grupach wiekowych mężczyzn
 |

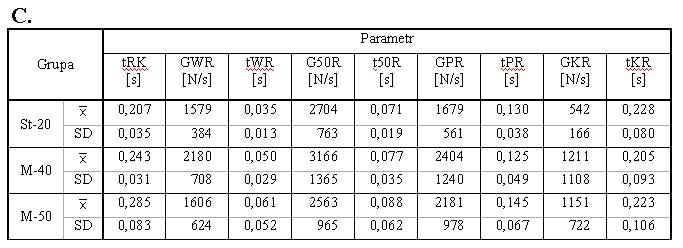
We wszystkich badanych kątach najwyższe wartości gradientu wczesnej relaksacji osiągali badani z grupy M-40 (tab. 4.6A,B,C). W kącie 60° jego średnia wartość w tej grupie była istotnie wyższa (p<=0,01; tab. 4.3A) od grup M-50 i S-60. W tym kącie uzyskali oni także istotnie wyższy gradient (p<=0,05) od grupy St-20. W kącie 60° również studenci osiągnęli istotnie wyższy gradient od grupy najstarszej (p<=0,01). W kolejnym kącie: 90° tylko najstarsi badani (S-60) uzyskali istotnie mniejszy GWR (p<=0,01) od gradientów pozostałych grup (St-20, M-40 i M-50). W kącie 120° pomiędzy poszczególnymi grupami nie zaistniały już istotne różnice (p>0,05), chociaż utrzymały się podobne różnice wartości średnich. Również w tym kącie najwyższy GWR uzyskali badani z grupy M-40.
W każdej grupie występują istotne różnice gradientów uzyskanych w poszczególnych kątach. Pomiędzy kątami 60° i 90° różnice są istotne w każdej z grup (p<=0,01; ryc. 4.18). Pomiędzy kątami 90° i 120° istotne różnice zanotowano tylko w grupie St-20 (p<=0,01), a w przypadku kątów 60° i 120°, w grupach St-20 i M-50 (p<=0,05).
Rysunek 4.18. Gradient wczesnej relaksacji (GWR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
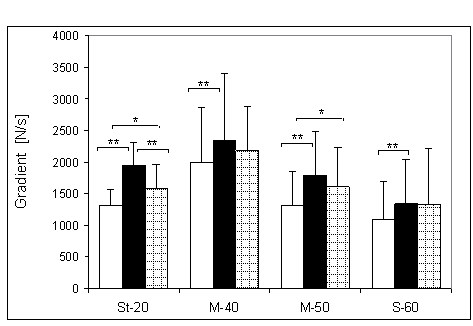
Czas trwania tej fazy jest coraz dłuższy w starszych grupach. W każdym kącie pomiarowym najkrótszy tWR osiągają badani grupy St-20 (tab. 4.6A,B,C). Badani kolejnych grup wiekowych mają coraz wyższe wartości tWR. Jednak istotne różnice uzyskane w każdym z kątów występują tylko pomiędzy grupami St-20 a S-60 (p<=0,01; tab. 4.3B). W dwu skrajnych kątach (60° i 120°) istotne są również różnice pomiędzy M-40 a S-60 (p<=0,05), a w kątach: 90o i 120o - pomiędzy St-20 a M-50 (również p<=0,05).
W najmłodszej grupie (w której średnia wartość tWR była najkrótsza) nie zauważa się różnic pomiędzy kątami pomiarowymi (p>0,05; ryc. 4.19). W pozostałych trzech grupach takie różnice występują. W grupach: M-40 i M-50, pomiędzy kątami 60° i 120°, a w najstarszej, pomiędzy kątami 90° i 120° (w każdym przypadku p<=0,05).
Gradient 50%R wykazuje w każdym z kątów podobny układ wartości średnich; największe gradienty osiągnęli badani z grupy M-40 (tab. 4.6A,B,C), następnie St-20 i M-50. Najniższe wartości tego gradientu wystąpiły w najstarszej grupie, S-60. Istotna różnica pomiędzy gradientami występuje w każdym kącie pomiarowym tylko pomiędzy grupami M-40 a S-60 (p<=0,01). Poza tym, w kącie 90° istotna różnica istnieje pomiędzy grupami St-20 a M-50 (p<=0,05; tab. 4.3A). Pozostałe gradienty nie różnią się istotnie w żadnym z kątów (p>0,05).
Największe różnice pomiędzy G50%R w trzech kątach wykazywali najmłodsi badani (St-20; ryc. 4.20). Pomiędzy kątami 90° i 60° oraz 90° i 120° różnica była istotna na poziomie p<=0,01, a w przypadku kątów 60° i 120° - na poziomie p<=0,05. W grupie M-40 różnica istotna wystąpiła pomiędzy kątami 90° i 120° (p<=0,01). W grupie M-50 różnicę na poziomie p<=0,01 stwierdzono dla kątów 90° i 60°, a w najstarszej (S-60), dla tych samych kątów, p<=0,05.
Pod względem połowy czasu relaksacji nie występują istotne różnice pomiędzy grupami w żadnym z kątów (p>0,05). Podobnie jak w fazie wczesnej relaksacji, czas połowy relaksacji w starszych grupach wiekowych jest coraz dłuższy (tab. 4.6A,B,C). Tylko w grupie St-20 istnieje różnica PtR pomiędzy kątami 90° i 120° (p<=0,05; ryc. 4.21). W pozostałych grupach pomiędzy kątami nie występują żadne istotne różnice połowy czasu relaksacji (p>0,05).
W porównaniu z poprzednią fazą, obserwuje się pewne spowolnienie spadku siły. Gradient późnej relaksacji osiąga poziom od 1552 N/s do 2747 N/s (tab. 4.6A,B,C). Także w tej fazie, najwyższa średnia wartość GPR w każdym kącie wystąpiła w grupie M-40. Najniższe gradienty tej fazy zanotowano w najstarszej grupie. W obu pozostałych wahały się w stosunkowo niewielkim zakresie od 1669 do 2290 N/s. W żadnym z kątów pomiędzy grupami nie było statystycznie istotnych różnic (p>0,05).
Największe różnice gradientów osiąganych w poszczególnych kątach wystąpiły w grupie St-20, pomiędzy kątami 60° a 90° oraz 90° a 120° (p<=0,01), oraz w grupach M-50 i S-60, dla kątów 60° i 90°. Nie wykazano istnienia takich różnic w grupie M-40 (ryc. 4.22).
Rysunek 4.22. Gradient późnej relaksacji (GPR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
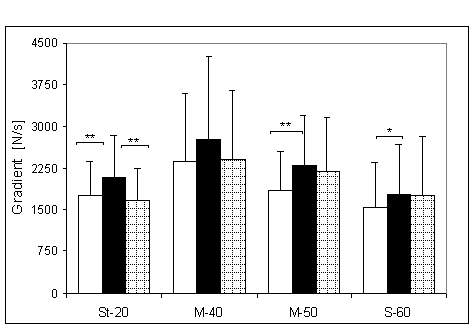
Bardzo niewielkie różnice tPR stwierdzono pomiędzy badanymi grupami w każdym z kątów (p>0,05), przy czym czas późnej relaksacji był wyraźnie dłuższy od czasu trwania poprzednich faz. Najmniejsze wahania wartości średnich występują w najmniejszym kącie 60° (od 0,112 do 0,118 s), w kącie 90°: od 0,117 do 0,132 s oraz w kącie 120°: od 0,125 do 0,151 s. W żadnej z trzech najstarszych grup nie wystąpiły istotne różnice czasu późnej relaksacji (tPR) pomiędzy kątami pomiarowymi (p>0,05). Istotne na poziomie p<=0,05 różnice stwierdzono wyłącznie w grupie St-20, dla kątów 60° i 120° oraz 90° i 120° (ryc. 4.23). Zwraca uwagę fakt, iż w tej grupie występują najmniejsze, w porównaniu z pozostałymi grupami, wahania indywidualnych wyników czasu kolejnych faz relaksacji: wczesnej, połowy i późnej.
Niewielkie różnice w poziomie gradientu końcowej relaksacji wystąpiły pomiędzy trzema starszymi grupami (M-40, M-50 i S-60). Wartości średnie wahały się w wąskich granicach (od 989 N/s do 1310 N/s) (tab. 4.6A,B,C). GKR grupy St-20 był wprawdzie wyraźnie niższy niż pozostałych w każdym kącie, jednak również w żadnym z nich nie była to, w zestawieniu z pozostałymi grupami, różnica znacząca statystycznie (p>0,05), głównie ze względu na duże, indywidualne różnice osiąganych gradientów końcowej fazy relaksacji.
Pomiędzy kątami pomiarowymi istotna różnica (p<=0,01) wystąpiła wyłącznie w grupie St-20 dla kątów 90° i 120° (ryc. 4.24). W innych grupach nie było istotnych różnic (p>0,05).
Czas trwania końcowej fazy narastania siły (tKR) był nieco dłuższy niż poprzedniej. Pomiędzy grupami w żadnym przypadku nie stwierdzono różnic istotnych statystycznie (p>0,05), a najkrótsze czasy były rejestrowane w kącie 60°, w którym średnie dla poszczególnych grup wahały się od 0,161 s do 0,190 s, w kącie 90°: od 0,190 s do 0,216 s, a w kącie 120°: od 0,193 s do 0,228 s (tab. 4.6A,B,C). Różnice średnich były więc nieznaczne. W trzech najstarszych grupach czas trwania tej fazy w trzech kątach pomiarowych nie wykazywał istotnych różnic (p>0,05). Tylko w grupie St-20 był on istotnie różny (p<=0,05) dla kątów 60° i 120° oraz 90° i 120°(ryc. 4.25).
Wartości indywidualne maksymalnego gradientu relaksacji w dwu młodszych grupach (St-20 i M-40) są w każdym z kątów bardzo zbliżone, a różnice pomiędzy nimi były nieistotne (p>0,05) (tab. 4.2A,B,C). W obu starszych grupach MGR jest wyraźnie niższy. Pomiędzy młodszymi a starszymi grupami występują znacznie wyraźniejsze różnice wartości tego parametru. Jednak statystycznie istotna różnica w każdym z trzech kątów dotyczy wyłącznie najstarszych badanych (S-60) i grupy M-40, a w kącie 60° także najstarszych i St-20 (tab. 4.3A). Charakterystyczny jest fakt, że w każdym kącie pomiarowym największy gradient jest osiągany przy rozwijaniu siły w wąskim zakresie od 54 do 59%.
Wystąpiły również istotne różnice gradientów w różnych kątach pomiarowych w każdej z grup. Jest charakterystyczne, że w żadnej z nich nie wykazano istotnych różnic pomiędzy kątami 60° i 120°, natomiast pomiędzy 60° a 90° oraz 90° i 120°w każdej z grup istnieją znaczące różnice (p<=0,05 lub p<=0,01; ryc. 4.26).
Rysunek 4.26. Maksymalny gradient relaksacji (MGR) oraz istotność różnic pomiędzy kątami pomiarowymi, w czterech badanych grupach. Oznaczenia jak na ryc. 4.1.
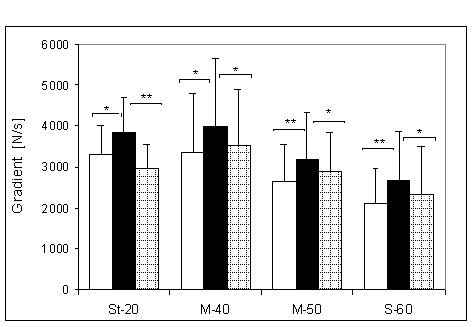
Czas osiągania maksymalnego gradientu (tMGR) w każdej z grup wahał się od 0,053 s do 0,080 s w kącie 60°, od 0,067 s do 0,108 s w kącie 90° oraz od 0,059 s do 0,110 s w kącie 120°. Różnice pomiędzy grupami są w każdym z nich nieistotne (p>0,05; tab. 4.3B), chociaż najstarsi badani (S-60) mieli najdłuższy czas uzyskania MGR. Stwierdzono również znaczące wahania indywidualne tego parametru, zwłaszcza w trzech najstarszych grupach (tab. 4.2A,B,C). Różnice czasu rozwijania MGR pomiędzy kątami były nieistotne (p>0,05), z wyjątkiem grupy St-20, w której różnica pomiędzy skrajnymi kątami 60° i 120° była istotna (p<=0,01; ryc. 4.27).
Podczas relaksacji we wszystkich fazach występuje istotna, ujemna zależność (p<=0,01) pomiędzy wiekiem a gradientami kolejnych faz relaksacji (w tym dla MGR) (tab. 4.5; ryc. 4.28). Wskazuje to na znaczące obniżanie się z wiekiem gradientów: wczes-nej połowy i późnej fazy relaksacji. Jednakże w fazie końcowej jest to zależność dodatnia (r = 0,24), wskazująca na wzrost GKR z wiekiem. Pomiędzy wiekiem a czasem trwania poszczególnych faz relaksacji dodatnia zależność (r = 0,48; p<=0,01) występuje tylko w fazie wczesnej relaksacji. Nie stwierdzono natomiast istotnej zależności (p>0,05) dla czasu pozostałych trzech faz relaksacji.
**: zależność istotna na poziomie p<0,01
Parametry somatyczne badanych mężczyzn nie wykazują istotnych statystycznie różnic pomiędzy poszczególnymi grupami (p>0,05). Charakterystykę czterech grup zawiera tabela 2.2.
Szybkość skurczu, określona na podstawie maksymalnego gradientu narastania siły, w obu grupach "szybkich" jest istotnie wyższa od osiąganego przez "wolnych", zarówno wśród studentów, jak i mężczyzn starszych, a różnice pomiędzy gradientami są wybitnie istotne statystycznie (p<=0,01) (tab. 4.7; ryc. 4.29). Nie ma istotnych różnic pomiędzy obiema grupami "szybkimi", natomiast znacznie większe różnice występują pod tym względem w grupach "wolnych". Pomiędzy żadną z grup nie występują istotne różnice pod względem czasu osiągania MGN (ryc. 4.30).
Tabela 4.7. Maksymalne wartości dowolnej siły izometrycznej [N] oraz gradientów narastania i relaksacji [N/s] oraz czasu ich osiągania [s], w grupach "wolnych" i "szybkich"
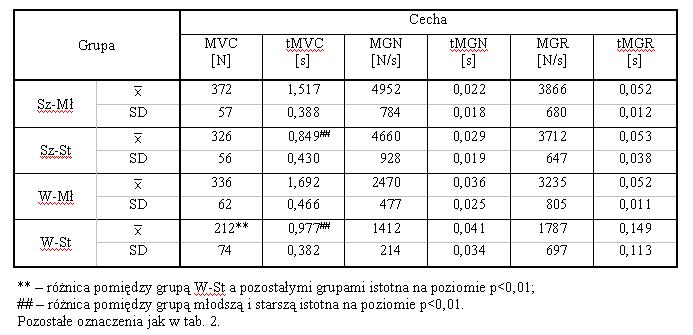 |
Rysunek 4.29. Maksymalny gradient narastania (MGN) oraz relaksacji (MGR) w grupach "szybkich" i "wolnych"
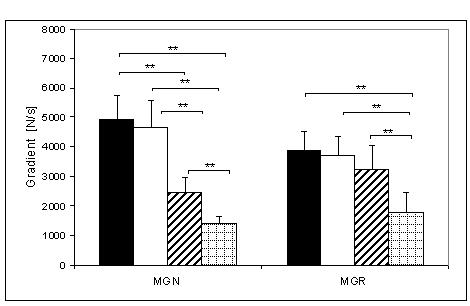

Niezbyt duże różnice pomiędzy grupami występują w zakresie osiąganej MVC. Istotna różnica (p<=0,01) występuje tylko pomiędzy grupą W-St a pozostałymi trzema grupami (tab. 4.7). Natomiast czas osiągania siły maksymalnej (tMVC) wyraźnie różnicuje grupy młodsze i starsze. W obu przypadkach różnice są istotne statystycznie (p<=0,01). Oznacza to, że starsi badani ("szybcy" i "wolni") osiągają niższe wartości siły w krótszym czasie.
Porównując badanych "szybkich" i "wolnych", zauważa się, że w pierwszej połowie narastania siły (tj. w fazie wczesnej i połowy narastania) wystąpiła istotna różnica gradientów pomiędzy badanymi obu "szybkich" i obu "wolnych" grup (p<=0,01; ryc. 4.31). W późnej fazie różnice występują tylko pomiędzy "szybkimi" starszymi - u których gradient był największy - a pozostałymi badanymi grupami. W fazie końcowej nie istniały już istotne różnice pomiędzy żadną z grup.
W przebiegu zmian podczas narastania siły w grupach "szybkich", pomiędzy osobnikami starszymi i młodszymi nie obserwuje się na ogół istotnych różnic w poziomie odpowiednich gradientów (p>0,05; (tab. 4.8; ryc. 4.31). W całym okresie narastania siły tylko gradient późnej fazy (GPN) jest wyraźnie większy w grupie starszych, którzy osiągnęli 2778 ( 2284, podczas gdy młodsi 1035 ( 467 N/s (p<=0,01). W fazie końcowego narastania różnice pomiędzy obiema grupami "szybkimi" ponownie nie były istotne. Gradient w młodszej grupie wyniósł 76 ( 33 N/s, a w starszej 93 ( 52 N/s (p>0,05; ryc. 4.32).
Rysunek 4.31. Gradient wczesnego narastania (GWN), połowy narastania (G50%N) oraz późnego narastania (GPN) w grupach "szybkich" (młodszej i starszej) i "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
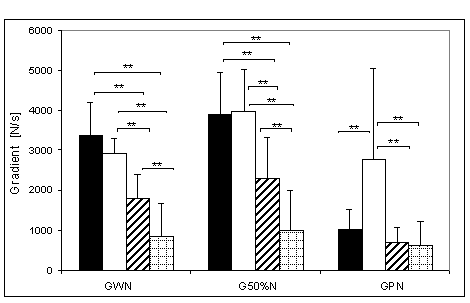
Rysunek 4.32. Gradient końcowego narastania (GKN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
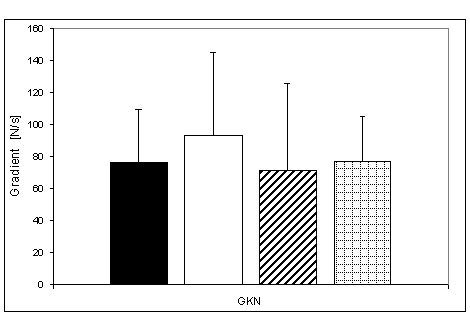
Dużo większe zróżnicowanie gradientów występuje natomiast pomiędzy grupami "wolnymi". Szczególnie istotne różnice występują w poziomie gradientu wczesnego narastania i 50% narastania, kiedy wartości w grupie studentów są ponad 2-krotnie wyższe niż u mężczyzn starszych. W późnej i końcowej fazie narastania dynamika skurczu zmniejsza się, a różnice pomiędzy grupami "wolnymi" zanikają (p>0,05) (tab. 4.8, ryc. 4.31, ryc. 4.32).
Podczas narastania siły nie występują istotne różnice czasu trwania poszczególnych faz pomiędzy studentami a starszymi mężczyznami, zarówno wśród "szybkich" jak i "wolnych" (ryc. 4.33). Mężczyzn "szybkich", w porównaniu z "wolnymi", cechuje krótszy czas wczesnego narastania (p>0,05; tab. 4.9). Wśród "wolnych" różnica pomiędzy grupami była znacznie większa. Zdecydowanie najdłuższy czas tej fazy uzyskali starsi, chociaż pomiędzy nimi a studentami różnica nie była statystycznie istotna (p>0,05).
Czas połowy narastania siły (PtN) nie wykazuje statystycznych różnic pomiędzy osobnikami starszymi a młodszymi ani w "szybkiej", ani w "wolnej" grupie (p>0,05; tab. 4.9, ryc. 4.33), chociaż starszych cechuje nieco dłuższy czas trwania tej fazy. Większe wartości PtN wykazują "wolni" badani, a czas obu tych grup różni się istotnie (p<=0,05 oraz p<=0,01) od czasu "szybkiej" grupy młodych badanych.
Rysunek 4.33. Czas fazy wczesnego narastania (tWN), połowy narastania (PtN) i późnego narastania (tPN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
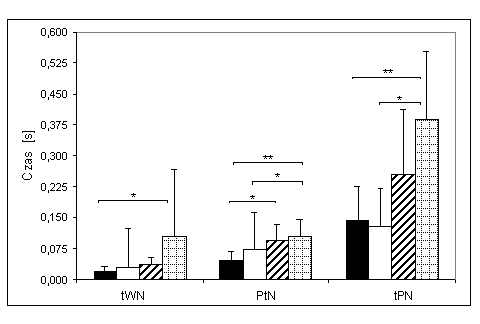
Czas późnej fazy narastania, w porównaniu z poprzednimi, jest znacznie dłuższy w każdej z grup (tab. 4.9). W obu "szybkich" grupach jest krótszy niż w "wolnych". Różnice istotne statystycznie stwierdzono tylko pomiędzy grupą W-St a obiema grupami "szybkimi": młodszej (p>0,01) oraz starszej (p>0,05) (ryc. 4.33).
Najdłużej trwa faza końcowego narastania. Wyraźniejsze jej wydłużenie zaznacza się szczególnie w obu młodszych grupach. Różnica istotna statystycznie pomiędzy młodszymi a starszymi wystąpiła zarówno w grupach "szybkich" jak i w "wolnych" (p<=0,01). Jednakże krótsze czasy tej fazy osiągają starsi badani (ryc. 4.34).
Rysunek 4.34. Czas fazy końcowego narastania (tKN) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
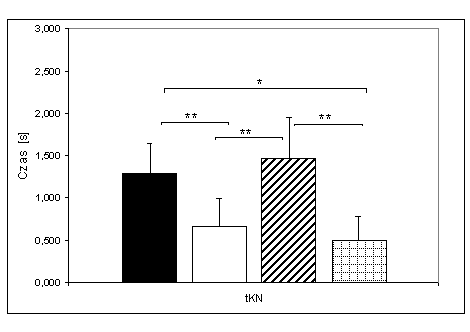
MGN, jako główny parametr wskazujący na poziom szybkości skurczu mięśniowego, jest w każdej z czterech grup istotnie (p<=0,01) powiązany z gradientem wczesnej relaksacji (wynosi od 0,54 do 0,92; tab. 4.10). W obu młodszych grupach ta zależność dotyczy również gradientu 50% narastania (0,68 i 0,84; p<0,01), a w "szybkiej" starszej wynosi 0,53 (p<0,05). W późnej i końcowej fazie nie ma istotnego związku pomiędzy MGN a gradientami tych faz. Nie ma również (poza jednym wyjątkiem) istotnego powiązania pomiędzy MGN a gradientami relaksacji (p>0,05; tab. 4.10).
Tabela 4.10. Korelacje pomiędzy MGN a gradientami narastania (A) oraz relaksacji (B), w grupach "szybkich" i "wolnych"
 |
Gdy weźmie się pod uwagę grupę złożoną ze wszystkich badanych o wysokim lub niskim MGN, zauważa się, że w grupie osób "szybkich" (n = 25) występuje istotny związek MGN z gradientami faz narastania siły (tab. 4.11): z GWN (r = 0,70), z G50%N (r = 0,73) (w obu przypadkach p<=0,01) oraz z GKN (r = 0,43) (p<=0,05). GPN nie jest istotnie powiązany z MGN (p>0,05). W grupie "wolnych" (n = 25), podczas narastania siły podobnie jak w grupie "szybkich" istotny związek z MGN wykazują gradienty wczesnej i połowy narastania (p<0,01), a gradienty fazy późnej i końcowej nie korelują z nim istotnie (p>0,05; tab. 4.12). W fazie relaksacji tylko gradient końcowej relaksacji nie jest istotnie skorelowany z MGN. Pozostałe współczynniki korelacji są istotne na poziomie p<=0,01 (tab. 4.12). W grupie "wolnej" uwidacznia się więc wyraźne, dodatnie powiązanie gradientów relaksacji z MGN.
Maksymalny gradient relaksacji nie wykazywał istotnych różnic pomiędzy starszą a młodszą grupą "szybkich" mężczyzn, a jego wartość w tych grupach była bardzo zbliżona. Istotnie niższy (p<0,01) MGR, w porównaniu z młodszymi "wolnymi", mieli natomiast starsi mężczyźni grupy "wolnej" (tab. 4.7; ryc. 4.29). Także czas osiągania MGR w tej grupie był istotnie dłuższy (p<0,01) niż we wszystkich pozostałych grupach, w których był niemal identyczny (tab. 4.7; ryc. 4.30).
Podczas pierwszych trzech faz relaksacji nie wystąpiły istotne różnice osiąganych gradientów pomiędzy młodszą a starszą grupą "szybkich" badanych. (p>0,05; tab. 4.13, ryc. 4.35). W grupach "wolnych" zauważa się natomiast istotnie wyższą (p<=0,01) wartość tych trzech gradientów w grupie studentów.
W końcowej fazie relaksacji starsi z grupy "szybkiej" uzyskali poziom gradientu około 2-krotnie przewyższający wyniki wszystkich pozostałych grup (tab. 4.13). Tylko pomiędzy tą grupą a trzema pozostałymi różnica była istotna (p<=0,01). Gradienty końcowej fazy pozostałych grup nie różniły się istotnie (ryc. 4.35).
Rysunek 4.35. Gradient wczesnej relaksacji (GWR), połowy relaksacji (G50%R), późnej relaksacji (GPR) oraz końcowej relaksacji (GKR) w grupach "szybkich" (młodszej i starszej) oraz "wolnych" (młodszej i starszej). Oznaczenia jak na ryc. 4.29.
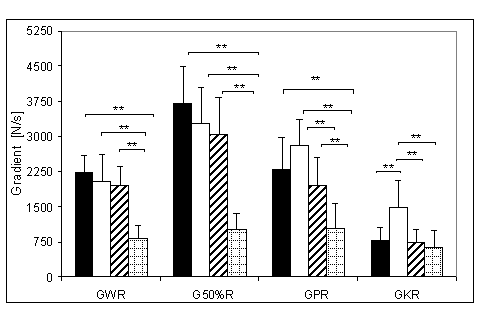
Znacznie większe, niż w zakresie uzyskanych gradientów, jest zróżnicowanie osobników grup "wolnych" i "szybkich" pod względem czasów osiąganych podczas relaksacji (tab. 4.14; ryc. 4.36). Nie stwierdzono istotnych różnic czasów wczesnej relaksacji (tWR) oraz połowy czasu relaksacji (PtR) pomiędzy młodszymi a starszymi grupami "szybkich" (p>0,05). Osiągnięty przez studentów tWR był krótszy niż w starszej grupie, a PtR w obu grupach był niemal identyczny (tab. 4.14). Pomiędzy grupami "szybkimi" istotne były różnice (p<=0,01) czasu późnej relaksacji (tPR) i czasu końcowej relaksacji (tKR). Natomiast pomiędzy obiema grupami "wolnymi" czasy wszystkich faz różniły się istotnie (p<=0,01). Wynika to z wyraźnie dłuższych wszystkich faz relaksacji w starszej grupie "wolnych" w stosunku do pozostałych trzech grup (tab. 4.14; ryc. 4.36).
Pod względem cech biometrycznych pomiędzy poszczególnymi grupami badanych mężczyzn nie stwierdzono istotnych statystycznie różnic (p>0,05). Szczegółowe dane czterech grup zawiera tabela 2.3.
Podstawowy parametr oceny wydolności fosfagenowej: maksymalna moc (Pmax) osiągana w próbie ergometrycznej, w obu starszych grupach ma znacznie mniejszą wartość niż w młodszych. Najwyższą moc rozwinęli badani z grupy M-40 (tab. 4.15). Tylko nieznacznie mniejsza jest wartość mocy uzyskana w grupie St-20. W obu najstarszych grupach Pmax była niższa, a statystycznie istotne różnice (p<=0,01) wystąpiły pomiędzy grupą M-40 a dwiema najstarszymi. Istotną różnicę (p<=0,05) stwierdzono także pomiędzy grupami St-20 a S-60 (ryc. 4.37). Również moc wyrażana na kg masy ciała jest w obu młodszych grupach istotnie wyższa (p<=0,01) od osiągniętej przez badanych obu starszych grup (ryc. 4.38). Ich średnie wartości w grupach St-20 i M-40 są identyczne i wynoszą 14,38 W/kg masy ciała. Badani z grup M-50 i S-60 osiągnęli moc: 11,37 W/kg oraz 10,64 W/kg (tab. 4.15). Bardzo podobnie kształtowała się moc wyrażana na kg LBM, wahając się od 16,74 W/kg w grupie M-40 do 13,86 W/kg w najstarszej grupie S-60 (tab. 4.15). Różnica pomiędzy obiema młodszymi a starszymi grupami była istotna statystycznie (p<=0,01).
Tabela 4.15. Parametry testu wydolności fosfagenowej mężczyzn z czterech grup: St-20 (n = 25), M-40 (n = 15), M-50 (n = 14) i S-60 (n = 8)
 |
Rysunek 4.37. Maksymalna moc (W) osiągana w teście mocy fosfagenowej oraz istotność różnic pomiędzy poszczególnymi grupami badanych
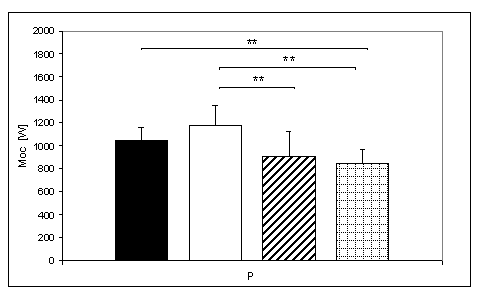

Oznaczenia: ** - różnica istotna na poziomie p<0,01
Rysunek 4.38. Maksymalna moc względna (W/kg masy ciała) osiągana w teście mocy fosfagenowej oraz istotności różnic pomiędzy poszczególnymi grupami badanych. Oznaczenia jak na ryc. 4.37.
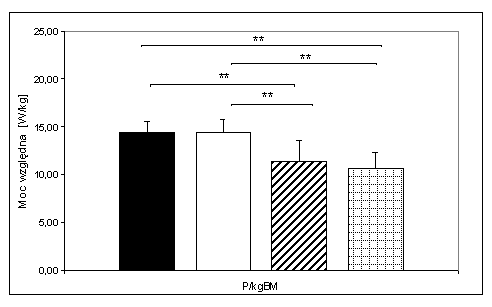
Wykazane różnice w poziomie rozwijanej mocy maksymalnej wynikają z nieco odmiennej zależności obu składowych mocy: siłowej (F) oraz szybkościowej (V). Grupy starsze charakteryzują się mniejszymi wartościami granicznej prędkości obrotów (V0), która wraz z wiekiem osiąga coraz niższą wartość. Natomiast graniczna siła oporu: F0 wydaje się być cechą znacznie mniej podlegającą wpływowi wieku. Charakterystykę zależności pomiędzy siłą oporu a częstotliwością obrotów w każdej z grup przedstawia rycina 43.
Rysunek 4.39. Charakterystyka zależności między siłą oporu a częstotliwością obrotów w czterech grupach badanych mężczyzn, w próbie ergometrycznej Vandewalle i wsp.
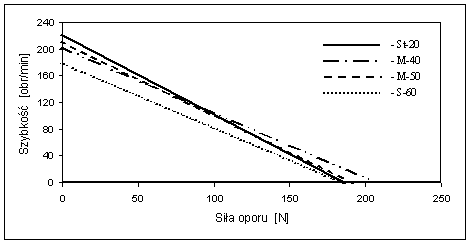
Pod względem granicznej wartości obrotów V0, najniższą wartość osiągnęli badani z grupy S-60; była ona istotnie niższa od obu młodszych grup: St-20 (p<=0,01) i M-40 (p<=0,05). Także różnica pomiędzy St-20 a grupą M-50 była istotna (p<=0,05; ryc. 4.40).
Druga ze składowych mocy maksymalnej: siła graniczna (F0) - była największa w grupie M-40. W pozostałych trzech grupach F0 była podobna (tab. 4.15). Istotna różnica (p<=0,05) istniała pomiędzy grupami M-40 a grupami St-20 oraz M-40 a M-50 (ryc. 4.41). Zarówno moc wyrażana w Watach, w Watach na kg masy ciała, jak też jej składowa szybkościowa (V0) wykazują ujemny związek z wiekiem. Jest to zależność statystycznie istotna (p<=0,05; ryc. 4.42, 4.43, 4.44).
Rysunek 4.40. Graniczna liczba obrotów (V0) w czterech badanych grupach oraz istotność różnic między nimi. Oznaczenia p<0,05; Inne: jak na ryc. 4.37.
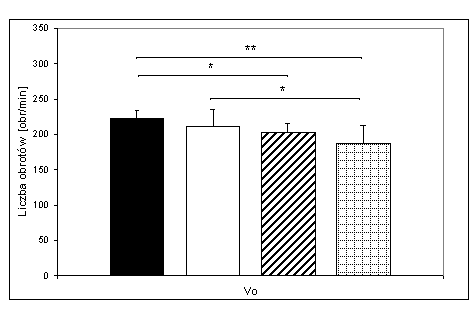
Rysunek 4.41. Graniczna siła oporu (F0) w teście mocy fosfagenowej w czterech badanych grupach oraz istotność różnic między nimi. Oznaczenia: jak na ryc. 4.37.
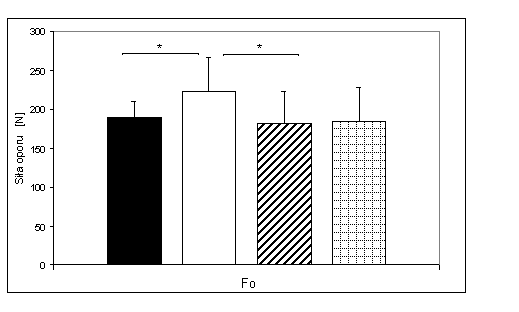
Rysunek 4.42. Zależność pomiędzy mocą maksymalną (Pmax) testu wydolności fosfagenowej a wiekiem badanych z grup: St-20, M-40, M-50 i S-60;
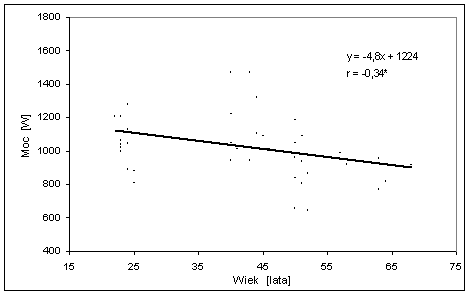
* - zależność istotna na pozimie p<0,05
Rysunek 4.43. Zależność pomiędzy względną mocą maksymalną (Pmax/kg) w teście wydolności fosfagenowej a wiekiem badanych z grup: St-20, M-40, M-50 i S-60;
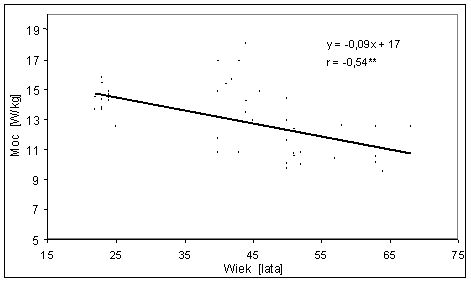
** - zależność istotna na poziomie p<0,01
Rysunek 4.44. Zależność pomiędzy graniczną liczbą obrotów w teście wydolności fosfagenowej a wiekiem badanych z grup: S-20, M-40, M-50 i S-60;
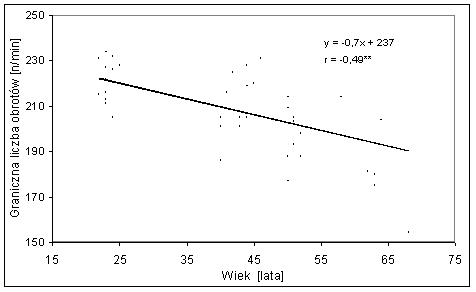
** - zależność istotna na pozimie p<0,01
Nieistotna jest natomiast korelacja pomiędzy wiekiem a siłą graniczną (p>0,05; ryc. 4.45). Znamienny jest fakt, że osiągana w próbie moc jest wybitnie skorelowana dodatnio (p<=0,01) ze składową siłową F0, zarówno dla całości badanych jak i dla każdej z grup z osobna. Składowa szybkościowa (V0) wykazuje istotny, ujemny związek z mocą maksymalną tylko w grupie M-50 (p<0,05). W pozostałych, zwłaszcza w obu najmłodszych grupach (St-20 i M-40) były to zależności nieistotne statystycznie (p>0,05; tab. 4.16).
Spis treści
- 5.1. Seria I: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a długością mięśni zginaczy stawu łokciowego.
- 5.1.1. WPŁYW ZMIAN KĄTA STAWOWEGO NA SIŁĘ MIĘŚNI
- 5.1.2. WPŁYW WIEKU NA PRZEBIEG NARASTANIA SIŁY W RÓŻNYCH KĄTACH
- 5.1.3. ZMIANY MVC ZACHODZĄCE Z WIEKIEM
- 5.1.4. CHARAKTERYSTYKA PRZEBIEGU RELAKSACJI
- 5.1.5. WPŁYW WIEKU NA PRZEBIEG RELAKSACJI
- 5.1.6. WPŁYW DŁUGOŚCI MIĘŚNI NA PRZEBIEG RELAKSACJI U OSÓB W RÓŻNYM WIEKU
- 5.2. Seria II: Wpływ wieku badanych mężczyzn na zależność między szybkością narastania siły i relaksacji a właściwościami kurczliwymi mięśni zginaczy stawu łokciowego.
- 5.3. Seria III: Wpływ wieku badanych mężczyzn na wielkość rozwijanej maksymalnej mocy beztlenowej-fosfagenowej w teście ergometrycznym.
Zmiany zachodzące w mięśniach prowadzą do zmniejszania się ich masy oraz zmiany cech jakościowych, powodując opóźnienie przebiegu tzw. sprzężenia elektro-mechanicznego w samym mięśniu oraz modyfikację pobudzania poszczególnych jed-nostek motorycznych. Oprócz spadku siły mięśniowej z wiekiem, dochodzi do obni-żenia innych, zewnętrznych efektów pracy mięśni. Maleje szybkość narastania siły i jej relaksacji, zwłaszcza przy uwzględnieniu zmian elastyczności mięśni. Stopniowa zmiana cech mięśni działających w obrębie tego samego stawu (agonistycznych, synergis-tycznych i antagonistycznych) może również prowadzić do ustalenia innej wartości kąta optymalnego w tym stawie.
Analiza poziomu MVC rozwijanej w różnych kątach wykazała, że następuje znaczący spadek jej wartości w starszych grupach badanych mężczyzn, jednakże spadek ten nie jest jednakowy w różnych kątach. Największy spadek MVC został stwierdzony w kącie mniejszym od optymalnego, a najmniejszy - w większym od optymalnego.
Warunki pracy mięśni zależą od ich długości, związanej ze zmianą kąta stawowego. Dochodzi wówczas do zmiany nie tylko rozwijanej przez mięśnie siły, ale również szybkości jej narastania i relaksacji. Ta tematyka jest rzadko poruszana w badaniach, które wykonuje się najczęściej przy zastosowaniu stymulacji elektrycznej [Herzog i wsp., 1990; Huijing, 1998; Marsh i wsp., 1981; Rassier i wsp., 1999]. Badania wpływu zmiany kąta stawowego na przebieg relaksacji mięśni są publikowane jeszcze rzadziej. Nie ma dotychczas pełnego rozpoznania, jak funkcjonują mięśnie osób starszych podczas pracy, w zależności od zmian ich długości wywołanej zmianą kąta stawowego. Nieliczne prace [np. van Schaik i wsp., 1994; Sica i McComas, 1971] charakteryzują tylko zmiany poziomu MVC, czasu uzyskania MVC oraz czasu połowy MVC i połowy relaksacji. Wyniki badań polotażowych przeprowadzonych przez autora z udziałem mężczyzn w różnym wieku wskazują, że przebieg narastania siły i jej relaksacji u osób starszych nie jest identyczny z młodymi badanymi. Uzyskane w niniejszej pracy wyniki potwierdzają powyższe spostrzeżenia. Wynika z nich, że najwyższe wartości MVC w każdej z badanych grup były osiągane w kącie 90o. Taki właśnie kąt jest uważany za kąt optymalny (Lo), tj. kąt, w którym jest osiągana największa wartość siły rozwijanej w stawie łokciowym, w warunkach skurczu izometrycznego. Badania przeprowadzone przy użyciu tej samej metody przez Jaskólską i wsp. [1999a] potwierdziły celowość zastosowania kąta 90o, jako optymalnego. Z pracy Nakazawy i wsp. [1993] wynika, że właśnie w kącie 90o występuje największe ramię działania głównych mięśni zginaczy stawu łokciowego: dwugłowego ramienia i ramienno-pro-mieniowego, przy najkorzystniejszym poziomie pobudzenia tych mięśni. Ważną rolę odgrywa również najsprawniejsze w tym kącie działanie sprzężenia elektromechanicznego, które jest warunkiem występowania największej liczby mostków aktynowo-miozynowych, obejmującej także głębiej umiejscowione sarkomery [Szczęsna i wsp., 1996]. W niniejszej pracy zaobserwowano niższe wartości MVC, zarówno w większym jak i mniejszym kącie, niezależnie od wieku badanych. Ponieważ obniżenie MVC wyrażane procentowo w stosunku do kąta 90° było w młodszych grupach (St-20 i M-40) podobne, wydaje się, że w tych grupach wiek badanych nie wywierał istotnego wpływu na poziom siły rozwijanej w kącie mniejszym i większym od optymalnego.
Dokładna analiza zależności między długością mięśni a rozwijaną siłą pozwala zauważyć, że wraz z wydłużeniem mięśni zmniejszają się różnice MVC rozwijanej w warunkach izometrycznych. W każdej z badanych grup występują istotne różnice w poziomie rozwijanej siły pomiędzy trzema zastosowanymi kątami. Szczególnie wyraźnie uwidaczniają się różnice pomiędzy wartością MVC w kącie optymalnym a uzys-kanymi w pozostałych dwu kątach. W każdym z zastosowanych kątów uwidoczniły się różnice rozwijanej siły pomiędzy niektórymi grupami wiekowymi. Największe różnice pomiędzy starszymi a młodszymi grupami wystąpiły w najmniejszym kącie (60°), nieco mniejsze są w kącie 90°, a najmniejsze w największym kącie (120°). Można więc sądzić, że w warunkach pracy wydłużonych mięśni (przy większym kącie stawowym) spadek maksymalnej siły z wiekiem jest mniejszy niż dla mięśni o długości optymalnej, a zwłaszcza w porównaniu z długością skróconą. Skuteczniejsze działanie mięśni zginających u osób starszych w większym kącie może wynikać np. ze zwiększenia udziału mięśnia 2-głowego ramienia w porównaniu z ramienno-promieniowym. Mięsień 2-głowy najkorzystniejsze warunki pobudzenia osiąga przy większym kącie stawu łokciowego, a ramienno-promieniowy - przy mniejszym. Jednocześnie w mięśniach kończyn górnych osób starszych nie następuje istotne pogorszenie pobudzania włókien mięśniowych. Z badań Mc Donagha i wsp. [1984] oraz van Schaik i wsp. [1994] wynika, że pobudzenie jednostek motorycznych zginaczy stawu łokciowego jest podobne do osób młodych oraz że w mięśniu dwugłowym ramienia nie zauważa się zwiększonego zaniku liczby włókien FTb [Mc Donagh i wsp., 1984]. Być może istotniejszą rolę w rozwijaniu siły u osób starszych mogą odgrywać inne mięśnie. Należą do nich zginacz promieniowy nadgarstka (ZPN) i zginacz łokciowy nadgarstka (ZŁN), które oprócz zasadniczych ruchów odwodzenia i przywodzenia mają pewien udział w zginaniu przedramienia w stawie łokciowym. U osób starszych może z czasem dochodzić do większego osłabienia mięśni agonistycznych (zginaczy stawu łokciowego) niż mięśni manipulacyjnych (ZPN i ZŁN) gdyż nawet kiedy aktywność fizyczna spada z wiekiem, to ruchy manipulacyjne ręki (np. ruchy chwytne czy pisanie) generalnie nie są ograniczane. Ponadto ruchy manipulacyjne rzadko wykonywane są przy małym kącie w stawie łokciowym. Najczęściej przedramiona (w stosunku do ramion) ustawione są pod kątem 90° lub większym. Stąd być może udział tych mięśni, ze względu na ich mniejsze osłabienie z wiekiem, jest większy w kącie 90° i 120°, powodując mniejszy spadek MVC podczas zginania stawu łokciowego w tych kątach w stosunku do kąta 60°.
Czas reakcji początkowej nie jest wskaźnikiem charakteryzującym przebieg narastania siły. Może jednak wskazywać na szybkość procesów w obrębie układu nerwowego oraz przewodnictwa synaptycznego. Najkrótszy czas reakcji początkowej we wszystkich kątach mieli badani najmłodszej grupy i różnił się on istotnie od grupy najstarszej. Największe różnice uwidoczniły się w kącie 90°. Z badań Enoki [1994b] wynika, że z wiekiem wzrastał czas reakcji rejestrowany podczas szybkich ruchów testowych rąk i wynikał on z pogorszenia procesów sensorycznych. Może do nich dochodzić na skutek zmian w osłonkach mielinowych, w wyniku których zaznacza się stałe, chociaż umiarkowane spowolnianie prędkości przewodzenia impulsów w nerwach rdzeniowych. Wydłużenie tRP w "pełnym" mięśniu zależy nie tylko od jego budowy, ale również od cech jego jednostek motorycznych, których funkcja może być modyfikowana przez indywidualną aktywność ruchową [Celichowski i wsp., 1998/99]. Bardzo powolny przebieg tych zmian może być powodem braku statystycznie istotnych różnic czasu reakcji początkowej pomiędzy trzema starszymi grupami mężczyzn.
Uzyskane wyniki wskazują na występowanie w każdej z czterech grup istotnych różnic w poziomie gradientów, charakteryzujących narastanie siły badanych mięśni. Niezależnie od wieku, zanotowano istotne różnice wartości gradientów wczesnego narastania siły i połowy narastania siły uzyskanej w kącie optymalnym, a pozostałymi dwoma kątami. W tej części skurczu o tempie narastania siły decyduje głównie ilość pobudzonych jednostek motorycznych, związana z uwalnianiem jonów Ca2+ z siateczki sarkoplazmatycznej, oraz kinetyka mostków miozynowych. Z badań m. in. Rack i Westbury [1972] wynika, że kurczliwość mięśni jest lepsza przy wydłużonym, niż przy skróconym mięśniu, co nie w pełni znalazło odzwierciedlenie w uzyskanych w niniejszej pracy wynikach. W większości badanych grup, największe gradienty wystąpiły w kącie 90o i były na ogół istotnie wyższe od osiąganych w dwu pozostałych kątach (60° i 120°). Z uzyskanych rezultatów wynikałoby, że skrócenie bądź wydłużenie mięśni, spowodowane zmianą kąta o 30°, pociąga za sobą wyraźne zmiany nie tylko w zakresie rozwijanej MVC, ale również pod względem dynamiki narastania siły mięśniowej w różnych jego fazach. Sugeruje to, że zastosowane kąty pomiarowe i związane z tym zmiany długości mięśni są wystarczające dla zmiany przebiegu narastania siły. Może to być m. in. skutkiem zmiany przestrzennego ułożenia białek kurczliwych, które wpływają na sprawność łączenia mostków przy wydłużonym i skróconym mięśniu, oraz ich przechodzenia ze stanu "słabego" do "mocnego" rozwijania siły. Z badań innych autorów [Ashley i wsp., 1993; Mero i wsp., 1981] wynika, że istotną rolę w procesie narastania siły może odgrywać także sprawność przyłączania jonów wapniowych do TnC.
O ile w badaniach z użyciem stymulacji elektrycznej wywołującej skurcz pojedynczy, wraz ze skracaniem długości mięśnia uzyskiwano skrócenie czasu osiągania siły maksymalnej [van Schaik i wsp., 1994; Marsh i wsp., 1981], to brak jest opublikowanych danych dotyczących czasów trwania poszczególnych faz narastania siły w skurczu dowolnym u osób w starszym wieku, z uwzględnieniem zmiany długości mięśni. W niniejszej pracy, najkrótsze czasy poszczególnych faz narastania występowały na ogół przy skróconych mięśniach. Brak znaczących różnic czasu trwania kolejnych faz narastania siły sugeruje, że sam czas nie jest czynnikiem dostatecznie charakteryzującym dynamikę narastania siły podczas skurczu dowolnego w różnych kątach stawowych, bez uwzględniania czynnika siły. Jest to spostrzeżenie zgodne z obserwacją van Schaik i wsp. [1994]. W pracy Jaskólskiej i wsp. [1999a] oraz Jaskólskiego i wsp. [2000], parametry wyznaczane według bardzo podobnej metodyki (w nieco innych kątach pomiarowych: 90°, oraz w kątach zmniejszonych lub zwiększonych o 10° i 20°) wskazują na podobne kształtowanie gradientów (głównie wczesnej oraz późnej fazy narastania siły) w kątach różnych od optymalnego, chociaż badani przez nas mężczyźni obu najstarszych grup uzyskiwali na ogół mniejsze bezwzględne wartości MVC i gradientów w pierwszej połowie narastania siły. Wskazywałoby to na podobny przebieg zmian jakościowych (zmniejszanie się MVC i gradientów w kątach większych i mniejszych od optymalnego) u osób w starszym wieku, przy jednoczesnym zmniejszaniu się uzyskiwanych gradientów, z wyjątkiem końcowych faz narastania. Ze względu na bardzo dynamiczny charakter skurczu podczas pomiaru, na poziom uzyskiwanych gradientów istotny wpływ może wywierać koordynacja mięśni antagonistycznych. Można przypuszczać, że ze względu na zmiany własności mięśni dokonujące się z wiekiem, wpływ tych mięśni może być znaczący. Van Schaik i wsp. [1994] podkreślają, że mięśnie antagonistyczne mogą mieć inną charakterystykę, np. mieć różną wartość kąta optymalnego nie tylko dla osiągania MVC, ale również dla gradientów narastania siły, co potwierdzają wyniki badań Singha i Karpovicha [1966]. U osób starszych może to być czynnikiem istotnie wpływającym na działanie mięśni, gdyż zmiany ich elastyczności mogą w znacznym stopniu modyfikować nie tylko oddawanie energii zgromadzonej w elementach sprężystych mięśni, ale zmieniać wzajemne oddziaływanie prostowników i zginaczy stawu łokciowego. Niektórzy autorzy uważają również, że podstawowe znaczenie dla utrzymania odpowiedniej sprawności mięśni u osób w starszym wieku może mieć duża aktywność fizyczna badanych [Young i wsp., 1985; Rogers i Evans, 1993].
Zmiany uzyskanych wartości MGN w trzech kątach są istotne i podobne do gradientu wczesnego narastania i połowy narastania siły. Analiza czasu wystąpienia MGN wskazała, że jest on osiągany w pierwszej części narastania, jest więc uzależniony od tych samych czynników, które wpływają na poziom gradientów wczesnego i połowy narastania.
Z przedstawionych badań wynika, że z wiekiem zmienia się charakterystyka działania badanych mięśni w zależności od kąta. Występuje różnica poziomu rozwijanej MVC oraz osiąganych gradientów pierwszej połowy narastania, pomiędzy kątem optymalnym a pozostałymi kątami. Stwierdzono również, że czas trwania poszczególnych faz skurczu jak i całego okresu narastania siły nie różnicuje wyraźnie działania tych mięśni w zależności od ich długości. Wskazuje to, że sam czas także u osób w starszym wieku nie jest czynnikiem dostatecznie charakteryzującym dynamikę narastania siły w warunkach izometrycznych.
Analiza poszczególnych faz narastania siły podczas skurczu dowolnego pozwala przeanalizować dynamikę jego przebiegu, uwzględniając wpływ wielu czynników modyfikujących działanie mięśni w warunkach przyżyciowych. Różnice wskaźników osiągniętych w czasie narastania siły w zależności od wieku dotyczą głównie początkowej i końcowej części narastania. Uwidaczniają się one szczególnie w wartościach gradientu początkowego narastania, maksymalnego gradientu narastania siły oraz czasu końcowego narastania. Zaznaczony jest również wpływ kąta na wielkość różnic tych wskaźników pomiędzy grupami wiekowymi.
Gradient wczesnego narastania jest jedynym gradientem w okresie narastania siły, wykazującym istotne różnice pomiędzy obiema młodszymi a najstarszą grupą badanych. Brak istotnych różnic pomiędzy pozostałymi grupami wiekowymi może wynikać z powolnych zmian dokonujących się zarówno w samych mięśniach, jak i w układzie nerwowym, i jest trudny do uchwycenia w grupach niewiele różniących się wiekiem. Szybsze tempo tych zmian dokonujących się u osób w wieku powyżej 60 lat, potwierdziły różnice występujące pomiędzy grupą S-60 a młodszymi badanymi. Przyjmuje się, że w mięśniach osób starszych dochodzi do zmniejszenia przekroju włókien typu FT, których wcześniej omówiona charakterystyka decyduje o dużej dynamice narastania siły. Wyrazem zmniejszenia się tej dynamiki są mniejsze gradienty, osiągane przez badanych starszych grup, zwłaszcza gradientu wczesnego narastania i połowy narastania siły. W tej części skurczu bardzo istotne znaczenie ma m. in. szybkość przyłączania jonów Ca2+ do cienkich filamentów aktynowych [Ashley i wsp., 1993; Szczęsna i wsp., 1996]. Milner-Brown i Stein [1973], Freund i wsp. [1975], Kukulka i Clamann [1981] oraz Oishi i Nigorikawa [1988] uważają, że w początkowej fazie skurczu dowolnego, aż do momentu uzyskania poziomu 50% MVC, głównym mechanizmem wzrostu siły jest liczba zrekrutowanych jednostek motorycznych. Zdaniem Lexella i wsp. [1983] zmniejszenie dynamiki narastania siły mięśni, zachodzące z wiekiem może wynikać nie tylko ze stopniowej redukcji przekroju włókien FT, odpowiedzialnych za generowanie skurczów o dużej dynamice, ale również z powodu zmian funkcjonowania centralnego i obwodowego układu nerwowego, sterującego pracą mięśni.
Ponieważ u osób młodych występuje większy niż u starszych sumaryczny przekrój włókien FT i są one w stanie generować większą siłę, to zgodnie ze spostrzeżeniami Mero i wsp. [1981] oraz Viitasalo i Komi [1981b], przy pobudzeniu dużej liczby włókien FT (a tym samym wytworzeniu dużej liczby mostków), może być osiągana większa prędkość narastania siły, wyrażana w N/s.
W badaniach przeprowadzonych przez Larssona i Edströma [1986] na szczurach wykazano, że szybkość skurczu zależy przede wszystkim od pojemności i wielkości wyrzutu jonów Ca2+ oraz od zawartości szybkiej i wolnej izoformy białek miofibrylarnych [Edström i Larsson, 1987; Kanda i Hashizume, 1989]. W badaniach na zwierzętach wykazano, że wpływ tych mechanizmów na szybkość narastania siły jest większy we włóknach FT niż w ST, jednakże włókna ST są mniej podatne na zmiany zachodzące z wiekiem [Larsson i Salviatti, 1989]. Natomiast w badaniach na mięśniach ludzkich Falco i wsp. [1992] oraz Schaumburg i wsp. [1983] dowiedli, że oprócz uprzednio wymienionych przyczyn, w rogach przednich rdzenia kręgowego, z wiekiem, wyraźnie zmniejsza się liczba aktywnych alfa-motoneuronów i zanikają ich aksony. Zastosowanie EMG potwierdziło zmniejszanie się liczby pobudzanych jednostek motorycznych, które stają się coraz większe [Doherty i Brown, 1993]. Ponadto stale spowalnia się proces pobudzania komórek motorycznych w OUN i przewodnictwo nerwowe oraz wzrasta opóźnienie synaptyczne. Wszystkie te czynniki są przyczyną wolniejszego narastania siły w początkowej fazie skurczu, w starszych grupach, w porównaniu z osobami w młodym wieku.
Największy przyrost siły (MGN) występuje najczęściej w pierwszej połowie skurczu. Nieco odmienna charakterystyka narastania siły u osób młodych i starszych powoduje, że (podobnie jak w przypadku GWN i G50%N) także w przypadku tego parametru, pomiędzy młodszą a starszymi grupami występują znaczące różnice. Największe różnice występują głównie pomiędzy grupami St-20 a S-60 i w największym kącie (120°) są znacznie mniejsze niż w dwu pozostałych kątach. Wskazywałoby to, że pod wpływem zmiany kąta i związanej z tym długości mięśnia nieco inną charakterystykę ma przebieg skurczu mięśni u osób młodych i starszych. Podobnie jak w przypadku MVC, gdzie najmniejsze różnice pomiędzy najstarszymi a młodszymi badanymi występują w kącie 120°, szybkość narastania siły w najstarszych grupach, w porównaniu z grupami młodszymi, najbardziej różni się w kącie 60°, a najmniej w kącie 120°.
Gradient połowy narastania oraz późnego narastania siły w obu młodszych grupach (St-20 i M-40), w kącie 120° zmniejsza się w porównaniu z Lo bardziej niż w obu starszych grupach (M-50 i S-60), chociaż różnice pomiędzy tymi grupami nie są statystycznie istotne. Podobny przebieg MVC i gradientów w kątach 60°, 90° i 120° w grupach starszych w porównaniu z młodszymi, przynajmniej częściowo można tłumaczyć faktem, że gradienty te wyrażono w N/s, a więc są w pewnym stopniu uzależnione od rozwijanej MVC.
Analiza wyników wykazuje, że u osób starszych występuje tendencja do wydłużania się czasu fazy wczesnego, połowy i późnego narastania siły oraz do skracania się czasu końcowego narastania i czasu uzyskania MVC. We wszystkich kątach występują bardzo znaczące różnice czasu końcowego narastania siły, pomiędzy młodszymi a starszymi grupami (nie występują one jeszcze w fazie późnego narastania). Większe gradienty późnego i końcowego narastania siły oraz krótszy czas końcowego narastania siły, stwierdzone w starszych grupach, można tłumaczyć zmniejszeniem się częstotliwości pobudzania oraz obniżonym progiem pobudliwości jednostek motorycznych osób starszych. Wcześniejsze aktywowanie jednostek wolno kurczących się (przy niższej częstotliwości pobudzania) umożliwia osobom starszym rozwijanie w krótszym czasie MVC [Newton i wsp., 1988]. Zatem uzyskaniu mniejszej wartości MVC u ludzi starszych, towarzyszy krótszy czas uzyskania MVC dzięki skróceniu czasu końcowego narastania siły. Jest to zgodne ze spostrzeżeniami Oishi i Nigorikawy [1988], z których wynika, że rozwijana przez mięśnie siła na poziomie od 80% do 100% MVC w największym stopniu zależy od zmiany częstotliwości pobudzeń już zrekrutowanych jednostek motorycznych, oraz od kinetyki mostków poprzecznych. Dlatego jest prawdopodobne, że skoro w rozwijaniu siły u ludzi starszych większy udział mają włókna ST i ich spektrum częstotliwości - przy którym uzyskują pełny tężec - jest mniejsze, to zgodnie z zasadą kolejności pobudzania w OUN, szybciej zostaną pobudzone wolne motoneurony, prowadząc do uzyskania przez nie niezbyt wysokiej wartości MVC. W końcowej fazie narastania siły u osób starszych, szybciej pobudzana jest większa liczba wolno kurczących się jednostek motorycznych, zanim zostaną pobudzone jednostki szybko kurczące się, które w mięśniach ludzi młodszych odgrywają większą rolę w stosunku do osób starszych. Potwierdzałoby to wyniki badań Krolla i Clarkson [1978], którzy stwierdzili, że osoby starsze rozwijają niższy absolutny poziom napięcia mięśni prostowników stawu kolanowego. Jest on jednak osiągany szybciej niż u młodszych, którzy rozwijają większe napięcie na tym samym, procentowo wyrażonym poziomie MVC. Tak więc, osoby starsze nie osiągają wysokich wartości gradientu narastania siły, wyrażanego w N/s, w żadnej z faz narastania siły mięśnia.
Badania maksymalnej siły izometrycznej uwidoczniły, że największa wartość MVC jest osiągana przez badanych z obu najmłodszych grup (St-20 oraz M-40), czyli tych, którzy nie przekroczyli 50. roku życia. W grupie M-50, a zwłaszcza w najstarszej rozwijana siła miała znacznie niższe wartości. Uzyskane wyniki są zgodne z poglądami tych autorów, którzy uważają, że siła jest cechą tylko nieznacznie obniżającą się od ok. 30. do 40. roku życia, a w starszym wieku jej spadek może być znacznie większy [Larsson i wsp., 1979]. Uzyskane w niniejszych badaniach wartości MVC, mierzone w kącie optymalnym (Lo) są zbliżone do wartości uzyskanych przez innych autorów, badających mężczyzn w analogicznym wieku, przy zastosowaniu zbliżonej metodyki [Jaskólski i wsp., 1999; McDonagh i wsp., 1984].
Wyrażony procentowo (w stosunku do obu grup młodszych łącznie) poziom rozwijanej siły, u badanych z grupy M-50 wyniósł 87%, a u najstarszych: 72% MVC osiąganej przez mężczyzn obu młodszych grup. Wykazany w tych grupach spadek siły potwierdza wcześniejsze wyniki badań [Clarkson i wsp., 1981; Aniansson i wsp., 1986], w których również wykazano stopniowe zmniejszanie poziomu MVC mięśni kończyn górnych z wiekiem. Istotne różnice w poziomie siły, występujące wyłącznie pomiędzy młodszymi a najstarszymi badanymi grupami, potwierdzają także spostrzeżenia autorów, którzy wykazali, że znaczący spadek tej cechy nasila się po 60. roku życia. [Larsson i wsp., 1979; Lexell i wsp., 1988]. Wysokie, istotne współczynniki korelacji, wskazujące na powiązanie spadku siły mięśniowej z wiekiem badanych, potwierdzają tę zależność także w omawianej grupie badanych, nie wskazując jednocześnie na przyczyny tego zjawiska. Przyjmuje się, że spadek siły, występujący szczególnie w starszym wieku, jest powiązany z zaobserwowanym spadkiem masy mięśni, a zwłaszcza masy (przekroju) włókien typu FT w tym okresie życia [Lexell, 1993; Clarkson i wsp., 1981]. Atrofia tych właśnie włókien może być przyczyną obniżania siły mięśniowej osób starszych. Według niektórych autorów [np. Kanda i Hashizume, 1989;Bemben i wsp., 1991; Brooks i Faulkner, 1994] osłabienie zdolności niektórych grup mięśni ludzkich do rozwijania i utrzymania MVC rozpoczyna się już w wieku 25-30 lat. Zmiany te są jednak trudne do wykazania, gdyż wymagają prowadzenia długotrwałych badań ciągłych, udziału dużej liczby osób (w coraz starszym wieku) oraz stosowania jednakowej metodyki pomiarów. Istotny wpływ ma również różna aktywność fizyczna i związany z nią wyjściowy poziom ocenianej siły dowolnej. Jak wynika z badań Lexella i wsp. [1983], do 50. roku życia siła zmniejsza się o ok. 10%. Wyraźne nasilenie tego zjawiska uwidacznia się między 50 a 60. rokiem, w zależności od grupy mięśni oraz od aktywności fizycznej człowieka [Brooks i Faulkner, 1994; Kanda i Hashizume, 1989; Larsson i wsp., 1979; Rogers i Evans, 1993; Vandervoort i McComas, 1986]. Te spostrzeżenia zostały potwierdzone w niniejszych badaniach. Istotne różnice występują niemal wyłącznie pomiędzy obiema młodszymi grupami a badanymi z najstarszej grupy mężczyzn. Należy wspomnieć, że zastosowana metodyka uwzględnia spostrzeżenia Clarkson i wsp. [1981], według których rzeczywisty poziom MVC u starszych może być osiągany tylko przy "eksplozywnym" charakterze skurczu mięśniowego, a jego brak w trakcie pomiaru mógł być częstą przyczyną przeszacowania różnic w poziomie rozwijanej MVC pomiędzy osobami młodymi a starszymi [Kent-Brown i Alexander, 1999].
Także po przeliczeniu MVC na cm obwodu ramienia istnieją znaczące różnice tak wyrażonej siły względnej. Są one niemal identyczne jak przy wyrażeniu MVC w Niutonach [N]. Ponieważ pomiędzy żadną z grup nie stwierdzono statystycznie istotnych różnic obwodu ramienia, to wykazane różnice siły mogą wynikać przede wszystkim z różnej sprawności procesów pobudzania nerwowo-mięśniowego. Nie badano wprawdzie udziału tkanki łącznej oraz tłuszczu podskórnego ramienia, jednakże - jak wynika z badania ogólnej zawartości tkanki aktywnej w całym organizmie - istotna różnica (p<=0,05) występuje wyłącznie pomiędzy grupami M-40 i S-60. Zmiany zawartości tkanki mięśniowej oraz tłuszczowej w obrębie kończyn górnych, zachodzące z wiekiem, mogą być jednak niewielkie [Frontera i wsp., 1991] i dlatego wskaźniki siły przeliczane na jednostkę obwodu ramienia mogą w znacznym stopniu odpowiadać sile wyrażanej w [N]. Tak więc zgodnie ze spostrzeżeniami Bruce i wsp. [1989], Daviesa i wsp. [1986], Vandervoorta i Mc Comasa [1986] oraz Younga i wsp. [1985] sama atrofia nie wyjaśnia spadku MVC z wiekiem, zwłaszcza że w badaniach Frontery i wsp. [1991] nie wykazano znaczących różnic w poziomie MVC osób młodych i starszych (w warunkach izokinetyki), przeliczanej na przekrój "pełnego" mięśnia. Warto zauważyć, że zgodnie z badaniami Bembena i wsp. [1995], zmiana masy ciała oraz zawartość i rozmieszczenie tłuszczu zmienia się znacznie wcześniej (około 40-50 roku życia) niż zmniejszenie udziału beztłuszczowej masy ciała, które następuje dopiero około 20 lat później.
Uzyskane w niniejszej pracy wyniki potwierdzają spostrzeżenia tych autorów, którzy spadek siły mięśniowej uzasadniają tzw. jakościowymi zmianami dokonującymi się z wiekiem, związanymi z procesami pobudzania nerwowo-mięśniowego, a nie wyłącznie spadkiem masy mięśniowej. Campbell i wsp. [1973] twierdzą, że występuje ścisły związek pomiędzy osiąganą MVC a liczbą jednostek motorycznych, a ta stale obniża się. Jednakże, pomimo stwierdzonego przez Tomlinsona i Irvinga [1977] oraz Doherty i wsp. [1993] 50% spadku liczby jednostek motorycznych zginaczy stawu łokciowego, MVC starszych mężczyzn, w zależności od badanej grupy mięśni, może osiągać około 60-70% wartości stwierdzanych u młodych ludzi. Rozwijana siła może więc mieć związek ze zmianą wzorca pobudzania włókien mięśniowych. Wskazuje się również na inne, istotne przyczyny spadku siły mięśniowej u osób w starszym wieku. Są tonp. zmiany hormonalne (tzw. męskie klimakterium), ograniczenie wewnątrzmięś-niowego przepływu krwi, pogorszenie przewodnictwa nerwowo-mięśniowego oraz zmiany zawartości białek kurczliwych i ich metabolizmu. Z badań Krolla i Clarkson [1978] wynika, że spadek siły jest również mocno uzależniony od indywidualnych cech osobniczych. Badania Frontery i wsp. [1988] oraz Rogersa i Evansa [1993] wykazały, że aktywny tryb życia może tę tendencję opóźnić lub nawet odwrócić, m. in. znacząco wpływając na aktywność enzymów mięśniowych. Wysoka indywidualna aktywność może uzasadniać uzyskanie przez badanych z grupy M-40, oraz w pojedynczych przypadkach przez kilku mężczyzn w starszym wieku, wysokiego poziomu rozwijanej MVC.
Z dotychczasowych badań wynika, że niezależnie od poziomu wyjściowego siły zawsze następuje stopniowy spadek MVC. Ma on miejsce u osób w starszym wieku - zarówno u byłych, wybitnych sportowców, jak i nietrenujących. Z badań Grimby i Saltina [1983] oraz Lexella i wsp. [1983] wynika, że jego przyczyną może być również nasilający się proces odnerwiania oraz reinerwacji włókien mięśniowych, wywołujący zjawisko grupowania włókien tego samego typu także u ludzi. Jest to przejaw reakcji kompensacyjnych organizmów osób starszych, prowadzących do powiększania się wielkości pozostałych jednostek motorycznych [McComas i wsp., 1971; Brown i Wilmore, 1972; Doherty i Brown, 1993]. To zjawisko potwierdzają wyniki badań Kandy i Hashizume [1989], którzy wykazali wzrost wielkości wolno kurczących się jednostek motorycznych. McDonagh i wsp. [1984] uważają, że spadek siły z wiekiem ma swoje przyczyny głównie w samej tkance mięśnia i nie wynika wyłącznie ze zmniejszenia sprawności sterowania przez OUN, gdyż stymulacja elektryczna wykazała takie same różnice w poziomie rozwijanej siły jak podczas badania siły dowolnej. Jednakże z badań van Schaik i wsp. [1994] wynika, że w przeciwieństwie do wywołanego skurczu pojedynczego ("twitch"), poziom MVC wyraźnie obniża się z wiekiem, co sugerowałoby istotny wpływ czynników leżących poza tkanką mięśnia.
Wykazano również, że badani najstarszej grupy (S-60) w każdym z kątów osiągali MVC w najkrótszym czasie, który w stopniu wybitnie istotnym statystycznie (p<=0,01) różnił się od czasu osiągania maksymalnej siły przez mężczyzn obu młodszych grup (St-20 i M-40). Istotne różnice w poziomie tego parametru wystąpiły również pomiędzy grupą M-50 a St-20. Tak więc niezależnie od zastosowanego kąta, obserwuje się znaczące skrócenie czasu osiągania MVC z wiekiem. Wykazane zmiany tMVC nie są zgodne z wynikami innych autorów [Brown i Hasser, 1996; Doherty i wsp., 1993; McDonagh i wsp., 1984]. Zanotowali oni wydłużenie czasu osiągania MVC w badaniach mięśni ludzkich, poddanych supramaksymalnej stymulacji. Spowolnienie szybkości narastania siły u osobników starszych autorzy ci uzasadniali przede wszystkim zmniejszeniem aktywności miokinazy, co wynika z opracowania Rogersa i Evansa [1993], oraz stopniowym zmniejszaniem się powierzchni przekroju włókien FTb w mięśniach, które zawierają więcej enzymów przemian beztlenowych [Borges i Essen-Gustavsson, 1989; Larsson, 1978]. Warto zaznaczyć, że tak znaczne wydłużenie czasu uzyskania MVC było wykazywane głównie w przypadku osób powyżej 70. roku życia [Davies i wsp., 1983; Vandervoort i McComas, 1986]. Jednakże niektórzy autorzy, wywołując skurcze pojedyncze zginaczy stawu łokciowego, również nie stwierdzali istotnego wydłużenia czasu narastania siły [Doherty i wsp., 1993]. Natomiast podczas skurczów dowolnych, brak istotnych zmian czasu osiągania MVC stwierdził również Bemben i wsp. [1991], rejestrując czasy podobne do prezentowanych w niniejszym opracowaniu. Wyniki dostępnych badań wskazują, że tMVC zależy w dużej mierze od grupy badanych mięśni. Wydłużenie czasu najczęściej stwierdzano w mięśniach kończyn dolnych, podczas gdy brak jego zmian z wiekiem notowano w mięśniach zginaczach stawu łokciowego. Ten fakt uzasadnia się brakiem wybiórczej atrofii włókien FT w mięśniu dwugłowym ramienia, podczas gdy w mięśniach kończyn dolnych ten proces zachodzi znacznie wyraźniej [Doherty i wsp., 1993; Newton i wsp., 1988]. Zanotowane w tej pracy skrócenie (w porównaniu z osobami w wieku 20-50 lat) czasu uzyskania MVC u badanych po 60. roku życia może wynikać ze spadku MVC w starszej grupie oraz ze skrócenia czasu końcowej, stosunkowo długo trwającej fazy narastania siły. Osiągnięty efekt w postaci skrócenia tMVC zostanie szczegółowiej omówiony przy analizie wyników końcowej fazy narastania siły.
Analiza przebiegu relaksacji na podstawie wielkości gradientów oraz czasu trwania poszczególnych jej faz, pozwala stwierdzić, że podobnie jak podczas narastania siły, cechuje ją różna dynamika przebiegu. Nie wykazuje ona jednak tak znaczących wahań jak w okresie narastania, a jej przebieg jest nieco szybszy. Znaczenie relaksacji dla funkcjonowania mięśni jest związane ze współdziałaniem mięśni antagonistycznych podczas ruchów cyklicznych, zwłaszcza wykonywanych z dużą szybkością. Szczególnie istotne jest badanie współdziałania mięśni w żywym organizmie, w którym właściwa koordynacja pracy różnych grup mięśniowych umożliwia ocenę ich stanu funkcjonalnego, uwzględniając wpływ układu nerwowego w zakresie regulacji.
W niniejszych badaniach wykazano znaczące spowolnienie, z wiekiem, tempa przebiegu wczesnej relaksacji i połowy relaksacji, na co wskazują zarówno niższe wartości gradientów, jak też dłuższe czasy trwania obu tych faz w porównaniu z młodszymi grupami. Różnice uwidoczniły się szczególnie wówczas, gdy porównywano parametry obu najmłodszych grup z najstarszą. Niższy poziom obu tych gradientów w każdym z kątów pomiarowych, notowany w grupie St-20 w porównaniu z M-40, nie wynika zapewne ze zmian zachodzących w organizmie z wiekiem, gdyż różnice ich wartości pomiędzy grupą St-20 a M-40 nie były istotnie (z wyjątkiem GWR w kącie 60o). Zmiany inwolucyjne stwierdzane u osób starszych dotyczą więc głównie tych mechanizmów, które są związane z dwiema początkowymi fazami relaksacji, czyli szybkości derekrutacji jednostek motorycznych mięśni agonistycznych i aktywności mięśni antagonistycznych. Na poziomie komórkowym zależą zaś od sprawności wychwytywania jonów Ca2+ przez siateczkę sarkoplazmatyczną oraz od szybkości rozłączania mostków aktynowo-miozynowych [Allen i wsp., 1989; Edwards i wsp., 1975; Gillis, 1985; Jones, 1981; Simmons i Jewell, 1974]. Włókna ST, które dominują w mięśniach osób starszych, charakteryzują się mniejszą, w porównaniu z włóknami FT, zawartością SS i mniejszą szybkością wychwytywania przez nią jonów Ca2+. Ponadto z wiekiem obserwuje się spadek aktywności Ca2+-ATP-azy, która jest główną przyczyną zmniejszenia szybkości przenikania Ca2+ przez kanaliki podłużne siateczki sarkoplazmatycznej [Aniansson i wsp., 1986; Golnick i wsp., 1991; Hunter i wsp., 1999]. Przypuszczalnie z wiekiem może dochodzić również do konwersji "szybkiej" miozyny w "wolną" [Edström i Larsson, 1987; Thompson i Brown, 1999], które to zjawisko wyraźniej występuje we włóknach wolno kurczących się [Edström i Larsson, 1987; Larsson i wsp., 1979]. Czynnikiem, który może wpływać na spowolnienie szybkości relaksacji lub narastania siły, mogą być również zmiany w obrębie tkanki łącznej włókien mięśniowych [Thompson i Brown, 1999].
Uzyskane we wszystkich grupach gradienty i czasy trwania późnej i końcowej fazy relaksacji różnią się między sobą tylko nieznacznie. Różnice w szybkości spadku napięcia w tych fazach relaksacji pomiędzy grupami wiekowymi są zależne od częstotliwości stymulacji wywołującej napięcie mięśnia, jednakże nie stwierdzono występowania istotnych różnic w poziomie gradientów, a zwłaszcza czasów trwania tych faz. Jak wynika z badań Westerblada i Lannergrena [1991], wyższa częstotliwość pobudzania, w porównaniu z niższą częstotliwością, podwyższa poziom maksymalnego gradientu relaksacji. Prawdopodobnie jednak ten czynnik nie wywołuje znaczących zmian zachodzących z wiekiem, które wywoływałyby zmiany szybkości w przebiegu drugiej połowy relaksacji, a ewentualne różnice w tym zakresie mogą być kompensowane przez oddawanie energii sprężystej, gromadzonej podczas skurczu, zarówno w elementach sprężystych mięśnia jak również w białkach kurczliwych mostków. Jak bowiem wynika z pracy Ettemy i Huijinga [1994], sztywność mięśni jest pośrednio zależna od ilości wiązań w mostkach i energia elastyczna zgromadzona podczas skurczu mięśnia zostaje zwracana w okresie jego relaksowania. Ze względu na zwiększającą się z wiekiem sztywność mięśni, zwłaszcza elementów sprężystych, wydaje się, że ten mechanizm może odgrywać istotną rolę w późnej i końcowej fazie relaksacji, i może znacząco różnić grupy młodsze i najstarszą. Jednakże uzyskane w niniejszej pracy wyniki wskazują, że różnice pomiędzy tymi grupami, aczkolwiek statystycznie nieistotne, są największe w fazie wczesnej i połowy relaksacji. Można przyjąć, iż na przebieg relaksacji u osób młodych i starszych istotny wpływ wywiera również odmienny sposób gromadzenia i oddawania energii elastycznej przez mostki poprzeczne włókien FT i ST. Modyfikacja poszczególnych faz relaksacji może wynikać z tego, iż włókna FT w fazie narastania siły łatwiej kumulują energię elastyczną w strukturze własnych białek kurczliwych, natomiast włókna ST mają większą zdolność do oddawania tej energii podczas relaksacji [Bosco i wsp., 1983]. Zmiany właściwości elastycznych białek kurczliwych i elementów szeregowych umieszczonych w strukturach ścięgnistych mogą sprzyjać ujawnianiu się z wiekiem różnic w przebiegu fazy relaksacji. Istotną rolę mogą odgrywać również mięśnie antagonistyczne, których energia elastyczna wpływa na przebieg relaksacji. Można więc przyjąć, że relaksacja w całym jej przebiegu wykazuje spowolnienie z wiekiem, ale największe zmiany dotyczą przebiegu fazy wczesnej i połowy relaksacji, zwłaszcza pod względem czasu trwania tych faz.
W literaturze nie spotyka się opublikowanych danych dotyczących charakterystyki poszczególnych faz relaksacji podczas skurczu dowolnego mięśni, powiązanych ze zmianą ich długości (zależnej od kąta stawowego) u osób w starszym wieku. W badaniach wykonywanych w warunkach przyżyciowych oraz przy użyciu stymulacji elektrycznej, oceny przebiegu relaksacji dokonywano głównie na podstawie czasu połowy relaksacji (PtR) lub maksymalnego gradientu relaksacji (MGR) [Edwards i wsp., 1977; Duchateau i Hainaut, 1985]. Hunter i wsp. [1999] oraz van Schaik i wsp. [1994] wykazali znaczące zmniejszenie MGR, a w kilku pracach [Ettema i Huijing, 1994; Vanderwoort i McComas, 1986; Davies i wsp., 1986], w różnych grupach mięśni u lu-dzi stwierdzono wydłużanie się z wiekiem czasu połowy relaksacji, co jest zgodne z wynikami uzyskanymi w niniejszej pracy, w kącie optymalnym.
Szczegółowa analiza przebiegu poszczególnych faz relaksacji, dokonana według procedury wprowadzonej przez Jaskólską (1998), wykazała, że osiągane w niniejszej pracy gradienty relaksacji zmieniają się wraz ze zmianą kąta stawowego, podobnie jak gradienty fazy narastania i rozwijana siła, tzn. że największe wartości notuje się w kącie 90°, a najmniejsze w kącie 60°. Jednakże tylko nieliczne publikacje uwzględniają badania osób w średnim bądź starszym wieku. Jak wynika z badań pilotażowych (badania własne), z wiekiem występuje spowolnienie relaksacji w całym jej przebiegu, a szczególnie w pierwszej jej połowie. W niniejszej pracy, najkrótsze czasy poszczególnych faz relaksacji występowały na ogół przy skróconych mięśniach, a więc w kącie 60° (z wyjątkiem grupy St-20). Brak znaczących różnic czasu kolejnych faz relaksacji pomiędzy różnymi grupami wiekowymi sugeruje, że podobnie jak podczas narastania siły, sam czas nie jest czynnikiem dostatecznie charakteryzującym dynamikę relaksacji po skurczu dowolnym. W tym celu należy uwzględnić także gradienty osiągane w każdym z kątów stawowych. Jest to spostrzeżenie zgodne z obserwacją Van Schaik i wsp. [1994]. Jednakże, w cytowanej pracy Jaskólskiej i wsp. [1999b] oraz Jaskólskiego i wsp. [2000], wykazano, że u badanych studentów miało miejsce istotne skrócenie podstawowego parametru charakteryzującego relaksację - czasu połowy relaksacji (PtR), w stosunku do długości mniejszej i większej od optymalnej. Takie wyniki znalazły częściowe potwierdzenie w niniejszych badaniach, gdyż w grupie St-20 najkrótszy czas był uzyskany w kącie 90° i był istotnie krótszy od uzyskanego w kącie 120°. Natomiast w żadnej z trzech starszych grup nie wystąpiły istotne różnice PtR uzyskanego w poszczególnych kątach. We wszystkich niemal grupach najkrótszy czas każdej z faz relaksacji zanotowano w kącie 60° (poza czasem wczesnej relaksacji w grupie St-20), co może być efektem oddziaływania dwóch istotnych czynników wpływających na przebieg relaksacji: zmniejszenia elastyczności mięśni oraz zmniejszonej sprawności działania siateczki sarkoplazmatycznej, które mogą doprowadzić do wydłużenia, szczególnie faz wczesnej i połowy relaksacji u osób starszych [Sica i McComas, 1971; Margreth i wsp., 1999]. Charakterystyczne jest spostrzeżenie, że niezależnie od kąta stawowego, największe różnice czasu poszczególnych faz relaksacji pomiędzy najstarszymi a najmłodszymi badanymi występują w fazie wczesnej relaksacji, a w kolejnych stopniowo maleją, a nawet zanikają. Wskazuje to, że decydujące znaczenie dla przebiegu relaksacji ma sprawność działania SS, której funkcja ma istotniejsze w porównaniu z elastycznością mięśni znaczenie dla przebiegu fazy wczesnej relaksacji i połowy relaksacji. Zwiększona sztywność mięśni osób starszych z jednej strony może zwiększać szybkość relaksacji [Ettema i Huijing, 1994], z drugiej jednak jest równoważona przez zwiększoną sztywność mięśni antagonistycznych. Taka sytuacja prawdopodobnie niweluje wyraźniejszy wpływ zmian elastyczności mięśni w starszym wieku na przebieg fazy relaksacji, co jest zgodne ze spostrzeżeniami van Schaik i wsp. [1994]. Nie bez znaczenia może być również wyraźne zmniejszanie się z wiekiem przekroju włókien FT w mięśniach, co wywołuje spowolnienie procesu skurczu mięśnia i relaksacji [Larsson i Salviatti, 1989].
Najwyraźniejszy wpływ kąta uwidacznia się w przypadku gradientu wczesnej i połowy relaksacji. Jego wartość w kącie 90° jest znacznie większa niż osiąganych w obu pozostałych kątach. Wyraźnie mniejszy wpływ kąta wykazano dla gradientu późnej relaksacji, a gradient końcowej fazy zmieniał się najmniej (różnice nieistotne statystycznie) w zależności od kąta w stawie łokciowym. Zmniejszenie szybkości relaksacji w fazie wczesnej, połowy i późnej, przy skróceniu mięśni (w kącie 60°) bądź przy jego wydłużeniu (w kącie 120°), może wynikać ze spowolnienia przebiegu procesów inicjujących przebieg relaksacji mięśnia. Z badań m. in. Rack i Westbury [1972] wynika, że w wymienionych fazach relaksacji największy wpływ na ich przebieg wywiera szybkość rozłączania mostków. Zależy ona od dysocjacji jonów wapnia od C-troponiny oraz od sprawności wychwytywania jonów Ca2+ przez siateczkę sarkoplazmatyczną [Fitts i wsp., 1982; Fryer i Neering, 1986; Larsson i Salviatti, 1989]. Takie spostrzeżenie potwierdza wyniki uzyskane przez Jaskólską i wsp. [1999b], którzy u młodych dorosłych badali zmiany MVC oraz gradienty relaksacji, wyznaczane według przyjętej w tej pracy metodyki, (chociaż w nieco innych kątach pomiarowych: 90°, zmniejszonych oraz zwiększonych o 10° i 20°). Uzyskali oni podobne zależności, związane ze zmniejszeniem się gradientów w kątach różnych od optymalnego (głównie wczesnej oraz późnej fazy relaksacji). Badani przez nas starsi mężczyźni uzyskiwali na ogół mniejsze niż w młodszych grupach bezwzględne wartości MVC i gradientów relaksacji, ale ich zachowanie w różnych kątach było podobne. Wskazywałoby to, że przebieg zmian jakościowych (wyraźne zmniejszanie się MVC i gradientów relaksacji w kątach większych i mniejszych od optymalnego) u badanych w starszym wieku jest podobny jak u badanych osób młodszych, z wyjątkiem końcowej relaksacji. Na poziom analizowanych parametrów istotny wpływ mogą wywierać mięśnie antagonistyczne. Mogą one mieć inną charakterystykę, np. inną wartość kąta optymalnego dla osiągania MVC niż dla gradientów relaksacji [Van Schaik i wsp., 1994]. U osób starszych może to być istotnym czynnikiem, gdyż następujące u nich zmiany elastyczności mogą w znacznym stopniu modyfikować nie tylko przebieg oddawania energii zgromadzonej w elementach sprężystych mięśni, ale zmieniać wzajemne oddziaływanie prostowników i zginaczy stawu łokciowego. Niektórzy autorzy uważają również, że podstawowe znaczenie dla funkcjonowania mięśni u osób w starszym wieku może mieć zmniejszona aktywność fizyczna badanych [Young i wsp., 1985; Rogers i Evans, 1993].
Zmiany uzyskanych wartości maksymalnego gradientu relaksacji, w kątach różnych od optymalnego, są istotne i podobne do gradientów wczesnej relaksacji i połowy relaksacji. Analiza czasu ich osiągania wskazuje jednak, że są one osiągane również w pierwszej połowie relaksacji, stąd duża ich zgodność w zakresie zmian wywołanych zmianą kąta pomiarowego.
Z przedstawionych rozważań wynika, że funkcja układu mięśniowego osób starszych zmienia się głównie w wymiarze jakościowym, związanym z przebiegiem procesów pobudzania i sprzężenia elektromechanicznego. Zaznaczony spadek siły rejestrowany w 7. dekadzie życia powoduje również zmniejszenie bezwzględnych wartości gradientów narastania siły i jej relaksacji, rozwijanych w każdym z kątów. Jednocześnie zauważa się występowanie różnic pomiędzy gradientami (zwłaszcza w pierwszej połowie relaksacji) rozwijanymi w różnych kątach. Różnice te ujawniają się najwyraźniej w wielkości gradientów uzyskanych dla mięśni skróconych (60°) i przy optymalnej długości (90°). Czas trwania poszczególnych faz jak i całego okresu relaksacji nie różnicuje funkcji mięśni w zależności od ich długości, co wskazuje, że sam czas - także u mężczyzn w starszym wieku - nie jest czynnikiem dostatecznie charakteryzującym dynamikę narastania i relaksacji.
Podsumowując, należy stwierdzić, że oprócz spadku poziomu maksymalnej, dowolnej siły izometrycznej w starszych grupach badanych mężczyzn, najistotniejszym spostrzeżeniem wynikającym z przeprowadzonych badań jest znaczący wpływ zmian długości mięśnia (uwarunkowanej przez kąt stawowy) na poziom rozwijanej MVC. Przy wydłużonych mięśniach (w większym kącie stawowym) spadek siły maksymalnej z wiekiem jest mniejszy niż dla mięśni o długości optymalnej, a zwłaszcza zmniejszonej. Dochodzi również do znaczącego spowolnienia z wiekiem tempa przebiegu faz wczesnej relaksacji i połowy relaksacji, na co wskazują zarówno mniejsze gradienty oraz dłuższe czasy trwania obu tych faz. Dochodzi jednocześnie do znaczącego skrócenia czasu trwania końcowej fazy narastania siły, a tym samym czasu osiągania MVC.
Cechy szybkościowe istotnie związane z wrodzonymi predyspozycjami do szybkiego lub wolnego rozwijania siły lub jej relaksacji, niezależnie od wieku, zależą od funkcjonowania układu nerwowego somatycznego, koordynującego pracę mięśni oraz od dominującego typu włókien mięśniowych. Zmiany zachodzące z wiekiem, zarówno w mięśniach jak też związane z koordynacją nerwowo-mięśniową u osób "szybkich" i "wolnych", mogą wywoływać w obu grupach nieco inne skutki związane z dynamiką narastania siły i jej relaksacją.
Wyniki uzyskane w niniejszej pracy wykazały, że różnice wartości gradientów narastania siły pomiędzy grupami "wolnymi" a "szybkimi" występują głównie w fazie wczesnego narastania i połowy narastania siły, a w fazach późnej i końcowej zanikają. Może to wynikać z różnego wzorca pobudzania włókien wolno kurczących się i szybko kurczących się, które decydują o wielkości rozwijanego napięcia oraz szybkości jego narastania w pierwszej połowie skurczu. O wielkości obu gradientów wyznaczanych w pierwszej połowie skurczu mięśniowego decydują bowiem jednakowe mechanizmy, związane głównie z rekrutacją jednostek ruchowych oraz z wiązaniem jonów Ca2+ z TnC. Brak istotnych różnic w poziomie gradientów, w końcowej fazie narastania, pomiędzy "szybkimi" a "wolnymi" jak też pomiędzy różnymi grupami wiekowymi może wynikać z faktu, że czynniki warunkujące przebieg narastania tej fazy nie są zależne od różnic w udziale włókien mięśniowych różnych typów.
Analiza przebiegu poszczególnych faz wykazała duże zróżnicowanie gradientów kolejnych faz narastania i relaksacji, w obu grupach. Jest to niezależne od indywidualnych cech związanych z szybkością działania mięśni i wynika z wpływu różnych mechanizmów, dominujących w poszczególnych fazach narastania i relaksacji. Z analizy indywidualnych danych wynika, że różnice wartości podstawowego parametru obrazującego dynamikę narastania siły, jakim jest MGN, są bardzo duże. Niezależnie od wieku, najwyższe indywidualne wartości MGN były prawie 7-krotnie większe od najniższych. Podobne proporcje występują także w zakresie gradientów wczesnego narastania i połowy narastania siły.
Charakterystyczne jest występowanie wyraźniejszych różnic wartości gradientów narastania siły pomiędzy starszą a młodszą grupą osób "wolnych". Starsi charakteryzowali się istotnie niższymi wartościami gradientu wczesnego i połowy narastania, które były około 2-krotnie niższe od młodszych. Tak wyraźnych różnic w wartościach gradientów pierwszej połowy narastania nie stwierdzono natomiast w grupach mężczyzn "szybkich". Pod względem obu tych gradientów istnieją także istotne różnice pomiędzy badanymi "szybkimi" a "wolnymi" obu grup wiekowych. Są to więc wskaźniki różnicujące badanych w podobnym stopniu jak MGN, zarówno pod względem cech układu mięśniowego, a w grupie "wolnych" również ze względu na wiek.
Istotne różnice pomiędzy młodymi a starszymi grupami pod względem szybkości narastania siły, występujące w grupach "wolnych" oraz brak takich różnic w grupach "szybkich" są zgodne z wynikami badań uzyskanymi przez Brooks i Faulknera [1988] oraz Larssona i Edströma [1986], którzy stwierdzili wydłużenie z wiekiem czasu rozwijania siły w mięśniu wolno kurczącym się. Autorzy ci uważają, iż wynika to przede wszystkim z przeobrażeń zachodzących w białkach miofibrylarnych (głównie we włóknach ST), zmian w przebiegu procesów tzw. sprzężenia elektromechanicznego we włóknach mięśniowych oraz ze zmian cech motoneuronów odpowiednich pól ruchowych rdzenia kręgowego. W mięśniu dwugłowym ramienia (najważniejszym w ruchu zginania), w którym nie występuje wyraźnie zaznaczona, wybiórcza atrofia włókien FT (w przeciwieństwie np. do kończyn dolnych, w których ten proces uwidacznia się wyraźniej), dochodzi do znacznego zwolnienia szybkości skurczu pojedynczego, zwłaszcza u osób, które przekroczyły 60. rok życia [Doherty i wsp., 1993; Nygaard i Sanchez, 1982]. Wynika z tego, że szybkość skurczu zginaczy stawu łokciowego może zależeć głównie od wzorca aktywacji odpowiednich motoneuronów. Na zmianę charakterystyki funkcjonalnej mięśni z wiekiem może w dużej mierze wpływać aktywowanie poszczególnych typów jednostek ruchowych. Konieczność regularnego obciążania mięśni kończyn górnych w warunkach codziennej aktywności może w większym stopniu przyczyniać się do zmniejszenia w nich atrofii włókien FT [Aniansson i wsp., 1981]. Przewaga włókien FT w mięśniach osobników "szybkich", przy wyraźniejszym obniżeniu częstotliwości pobudzania "wolnych" jednostek z wiekiem, może spowodować mniejszy spadek szybkości skurczu w porównaniu z osobami z przewagą włókien ST. Odwrócenie wzorca pobudzania obserwowane podczas nagłego wzrostu napięcia mięśni, wykazane przez Grimby i Saltina [1983], kiedy jako pierwsze aktywowane są włókna FT, może u "szybkich" wywoływać z wiekiem mniejszy, w porównaniu z "wolnymi", spadek szybkości narastania pierwszej połowy MVC. Jednocześnie Claflin i Faulkner [1985] w swoich badaniach stwierdzili, że szybkość skurczu mięśnia o mieszanym składzie włókien (takim jak np. mięsień dwugłowy ramienia) przekracza szybkość skurczu rozwijaną przez włókna ST, wnioskując, iż na szybkość narastania siły w mięśniach mieszanych dużo większy wpływ mogą wywierać włókna szybkie niż wolne.
Podczas pierwszej połowy narastania siły nie występują natomiast istotne różnice czasu osiągania określonych poziomów MVC pomiędzy studentamia starszymi mężczyznami, tak wśród "szybkich" jak i "wolnych". Krótsze czasy wczesnego narastania oraz połowy czasu narastania cechują osobników "szybkich" i z reguły są tylko nieznacznie krótsze w grupach młodszych. Oznacza to, że podczas skurczu zginaczy stawu łokciowego mechanizmy odpowiedzialne za przebieg tej fazy nie podlegają istotnemu wpływowi wieku, chociaż czas trwania poszczególnych faz narastania u osobników "szybkich" (w obu grupach wiekowych) jest krótszy niż u "wolnych". Należy jednak pamiętać, że w tej części skurczu osobnicy "szybcy" osiągają, w porównaniu z "wolnymi", wyższe gradienty narastania siły.
W fazie późnego narastania gradient (wyrażony w N/s) w mniejszym stopniu różnicował "szybką" i "wolną" grupę młodszych mężczyzn, w porównaniu ze starszymi. W grupie starszej "szybkiej" (Sz-St) miał on istotnie większą wartość niż w pozostałych grupach. Zwraca natomiast uwagę dłuższy czas trwania tej fazy skurczu obu grup wiekowych "wolnych" badanych.
W fazie końcowej większe gradienty narastania mieli mężczyźni starszych grup, zarówno wśród "szybkich" jak i "wolnych". Różnice wartości tych gradientów nie są wprawdzie duże, jednakże - jak wynika z poprzedniego rozdziału - jest to tendencja wyrażająca wyraźną zmianę charakterystyki przebiegu skurczu mięśnia z wiekiem, także przy podziale badanych na "szybkich" i "wolnych". Istotne jest również spostrzeżenie, że różnicy wartości gradientu końcowego narastania towarzyszy istotne skrócenie czasu trwania tej fazy w obu grupach starszych. Oznacza to, że osoby starsze osiągają niższe wartości siły w krótszym czasie, niezależnie od właściwości kurczliwych mięśni określanych za pomocą MGN, co potwierdza spostrzeżenia Naczka [2000]. Jednocześnie warto zauważyć brak istotnych różnic zarówno pod względem gradientów jak i czasu trwania tej fazy pomiędzy grupami "szybkimi" a "wolnymi", zarówno w młodszych jak i w starszych grupach. W skurczu dowolnym, podstawowe różnice szybkości przebiegu narastania siły (gradientów) pomiędzy grupami są więc związane z tymi fazami, w których istotną rolę odgrywa szybkość rekrutacji jednostek ruchowych mięśni agonistycznych, uwalnianie jonów Ca2+ oraz kinetyka mostków poprzecznych [Round i wsp., 1984; Jaskólska, 1998; McDonagh i wsp., 1984]. Wyraźne różnice dotyczą również czasu trwania końcowej części skurczu. Należy mieć na uwadze fakt, że różna szybkość rozwijania siły przez włókna ST i FT (których zawartość u osób "szybkich" i "wolnych" jest przypuszczalnie różna) wynika głównie z różnej aktywności ATP-azy miofibrylarnej oraz z różnej zawartości jonów Ca2+ w cytoplazmie. Przebieg końcowej fazy zależy głównie od zmiany częstotliwości pobudzania już zrekrutowanych jednostek ruchowych oraz od kinetyki mostków poprzecznych.
Przyczyny zmian zachodzących z wiekiem w mięśniach prawdopodobnie nie tkwią wyłącznie w nich samych. Brown i Hasser [1996] uważają, że istotną rolę mogą odgrywać procesy związane z koordynacją nerwowo-mięśniową, co uniemożliwia proste przenoszenie wyników badań prowadzonych na pojedynczych włóknach, na funkcjonowanie całych mięśni lub grup mięśniowych. Cechy włókien są bowiem w znaczącym stopniu uzależnione od funkcjonowania motoneuronów rdzenia kręgowego. Motoneurony o wysokim progu pobudliwości, aktywowane przez bodźce o dużej sile, wywołują skurcze o dużym napięciu lub dużej szybkości ruchu. Bardzo istotną rolę w procesie pobudzania i szybkości skracania mięśnia odgrywa również pojemność siateczki sarkoplazmatycznej oraz sprawność uwalniania oraz wychwytywania Ca2+, a z drugiej strony skład i specyficzna aktywność "szybkiej" i "wolnej" izoformy miofibrylarnej miozyny zarówno we włóknach szybko-, jak i wolno kurczących się [Larsson i Salviatti, 1989]. Zmiany tych właściwości zachodzące z wiekiem nie są dostatecznie udokumentowane. Przypuszcza się jednak, że są spowodowane przede wszystkim zmianami cech samych motoneuronów oraz zmianami w syntezie i metabolizmie białek kurczliwych [Borg, 1981].
Szybkość początkowych faz relaksacji podczas skurczów tężcowych jest uzależniona głównie od sprawności procesów przebiegających w odwrotnym do okresu narastania kierunku, tzn. derekrutacji włókien, sprawności wychwytywania Ca2+ przez siateczkę sarkoplazmatyczną oraz od szybkości rozłączania mostków aktynowo-miozynowych [Jones, 1981]. Mogą one w podobnym stopniu jak podczas fazy narastania silnie różnicować funkcję włókien FT i ST. Zaobserwowane w niniejszej pracy spowolnienie relaksacji z wiekiem potwierdzają wyniki uzyskane w innych badaniach [Brooks i Faulkner, 1988; Brown i Hasser, 1996; van Schaik i wsp., 1994]. Z uzyskanych w niniejszej pracy danych wynika, że mniejsza dynamika wczesnej, połowy i późnej fazy relaksacji dotyczy przede wszystkim grup "wolnych". Jeżeli przyjąć, że niezależnie od wieku badani, których cechuje mniejsza wartość MGN, charakteryzują się większą odsetkową zawartością włókien ST w pracujących mięśniach, to uzyskane wyniki gradientów relaksacji sugerują, że z wiekiem, większe spowolnienie wczesnej, połowy, późnej i końcowej fazy relaksacji występuje właśnie u osobników z większą zawartością włókien wolno kurczących się. U osób z wyraźną przewagą włókien FT (tzw. szybkich) różnice szybkości przebiegu tych faz są mniejsze i nieistotne, zwłaszcza w fazie wczesnej i połowy relaksacji. Jednocześnie wyraźnie dłuższe czasy późnej i końcowej relaksacji występują w grupach starszych w porównaniu z młodszymi. Wynika z tego, że zmiany fazy wczesnej i połowy relaksacji z wiekiem zależą również od składu włókien; im więcej włókien ST, tym spowolnienie tych faz z wiekiem jest większe. Spowodowane to może być tym, że mniejsza szybkość przebiegu relaksacji wiąże się z wyraźniejszym zmniejszeniem częstotliwości pobudzania głównie wolno kurczących się jednostek motorycznych.
Wyraźniejszy, notowany w starszych grupach, spadek gradientów relaksacji u osób "wolnych" może wynikać z odmiennych mechanizmów wpływających na przebieg relaksacji w poszczególnych fazach. Może też w pewnym stopniu zależeć od tych czynników, które wpływają na poziom rozwijanej MVC, ponieważ gradienty te wyrażane są w N/s. Mniejsza szybkość przebiegu relaksacji z wiekiem może wynikać ze zmniejszenia częstotliwości pobudzania jednostek motorycznych (głównie wolno kurczących się), jak również z obserwowanego u osób starszych spadku aktywności Ca2+-ATP-azy i zmniejszonej szybkości zwrotnego wychwytywania Ca2+ przez siateczkę sarkoplazmatyczną [Golnick i wsp., 1991; Hunter i wsp., 1999]. Jednakże ten proces nie przez wszystkich jest potwierdzany. Nie wykazano bowiem znaczącej modyfikacji aktywności ATP-azy miozynowej w badaniach innych autorów, prowadzonych na zwierzętach [Baranyi, 1967; Reiser i wsp., 1985; Brooks i Faulkner, 1988; Florini i Ewton, 1989]. Z badań Campbella i wsp. [1973], Edströma i Larssona [1987] oraz Kandy i Hashizume [1989] wynika jednak, że mięśnie ludzkie są znacznie bardziej podatne na zachodzące z wiekiem zmiany funkcjonowania, wynikające z odnerwiania i atrofii włókien. Czynnikiem, który może dodatkowo wpływać na zwolnienie szybkości narastania siły lub relaksacji mogą być również zmiany w obrębie tkanki łącznej włókien mięśniowych. Należy bowiem przyjąć, że wzrost zawartości tkanki łącznej z wiekiem spowalnia przebieg skurczu obu typów włókien mięśniowych [Thompson i Brown, 1999]. Przypuszczalnie może dochodzić również do konwersji "szybkiej" miozyny w "wolną" [Edström i Larsson, 1987; Thompson i Brown, 1999], co uzasadniałoby uzyskane wyraźniejsze zróżnicowanie pomiędzy starszymi a młodszymi w grupie "wolnej", gdyż to zjawisko wyraźniej występuje we włóknach wolno kurczących się [Larsson i Salviati, 1989; Edström i Larsson, 1987].
Istotne znaczenie w przebiegu relaksacji (szczególnie w pierwszej połowie) może wywierać również działanie białek regulacyjnych w mięśniach, takich jak parvalbumina, kalmodulina i kalsekwestryna, które biorą udział w transporcie jonów wapniowych oraz aktywizują różne układy enzymatyczne, przez co mogą znacząco wpływać na szybkość przebiegu relaksacji [Pollack, 1990; Müntener i wsp., 1995].Można przypuszczać, że znaczenie tych białek dla funkcjonowania różnych typów włókien mięśniowych jest duże, zwłaszcza że parvalbumina (której działanie badano najczęściej) występuje przede wszystkim we włóknach FT. Heizmann i wsp. [1982], Müntener i wsp. [1995] wykazali, że stężenie parvalbuminy (PV) we włóknach typu ST i FT jest różne i znacząco wpływa na czas relaksacji. Wyższe stężenie PV we włóknach FT było związane ze skróceniem połowy czasu relaksacji. Na odmienny przebieg relaksacji, u osób o różnych cechach mięśni, może wpływać również częstotliwość pobudzania włókien. Huxley [1980] i Jones [1981] opisują wyraźne skrócenie czasu relaksacji w miarę wzrostu częstotliwości pobudzania włókien. Znacząco większa częstotliwość pobudzania jednostek FT powoduje m. in. szybszy przebieg relaksacji w tego typu włóknach. Wydłużenie czasu relaksacji, stwierdzane u osób starszych [Larsson i wsp., 1991], może być również powiązane z obserwowanym u nich spowolnieniem częstotliwości pobudzania jednostek motorycznych, głównie wolno kurczących się [McDonagh i wsp., 1987].
Uzyskane wyniki wskazują jednocześnie, że z wiekiem dochodzi do wydłużenia czasu poszczególnych faz relaksacji. Wydłużenie czasu jest wyraźniejsze niż zmniejszenie wartości gradientów odpowiednich faz relaksacji w obu grupach: "szybkiej" i "wolnej". Dłuższy czas połowy relaksacji w mięśniach kończyn dolnych u ludzi starszych wykazali m. in. Hunter i wsp. [1999] oraz Vandervoort i McComas [1986], którzy w badaniach stosowali stymulację elektryczną. Przeciwnie McDonagh i wsp. [1984] oraz Doherty i wsp. [1993], którzy nie stwierdzili zmian czasu relaksacji zginaczy stawu łokciowego podczas skurczów pojedynczych. Stymulacja elektryczna nie zawsze jednak odzwierciedla funkcjonowanie mięśni w warunkach przyżyciowych. Jednocześnie, w badaniach Hunter i wsp. [1999] nie wykazano, aby zmiany czasu relaksacji były powiązane ze spadkiem aktywności Ca-ATP-azy. Spowolnienie późnej i końcowej fazy relaksacji (wyrażone czasem trwania tych faz) wydaje się być wywołane czynnikami niezależnymi od składu włókien mięśniowych. Może to sugerować, że szybkość relaksacji od 50% MVC do 0% MVC zależy w dużym stopniu od tych właściwości mięśni, które nie różnicują znacząco włókien ST i FT, np. od wpływu mięśni antagonistycznych i w pewnym stopniu od ich elastyczności. Gradienty późnej i końcowej relaksacji, wyrażone w N/s (zależne m. in. od wartości MVC), wykazały, że przebieg zmian dokonujących się z wiekiem w grupie "szybkiej" był odmienny niż w grupie "wolnej". Wyznaczone w tej grupie gradienty późnej relaksacji oraz gradienty końcowej relaksacji miały większe wartości w grupie starszych, niż w grupie młodszych mężczyzn. Może to wynikać ze współdziałania mięśni agonistycznych i antagonistycznych, mających wpływ na płynność ruchów, przy zmieniającej się dynamice przebiegu narastania siły i relaksacji.
Godny podkreślenia jest fakt stwierdzonego w niniejszych badaniach istotnego związku pomiędzy maksymalnym gradientem narastania siły (MGN) a gradientami relaksacji (poza fazą końcowej relaksacji), który stwierdzono tylko w grupach "wolnych" (starsi i młodsi badani łącznie). Istnienie tak odmiennych zależności może wynikać także z różnicy zawartości włókien ST i FT w grupie "wolnych" i "szybkich". Konsekwencją przewagi włókien ST w mięśniach osób "wolnych" są niższe wartości MVC oraz gradientów narastania siły i relaksacji w początkowych fazach. Z badań Bosco i wsp. [1983] oraz Gowitzke i Milner [1988] wynika, że skład włókien może również w inny sposób modyfikować przebieg poszczególnych faz relaksacji, gdyż włókna FT łatwiej kumulują energię elastyczną w strukturze własnych białek kurczliwych, natomiast włókna ST mają większą zdolność do uwalniania tej energii w fazie relaksacji. Nie stwierdzono natomiast żadnego istotnego związku MGN z czasem trwania poszczególnych faz relaksacji, co wynika - chociażby częściowo - z innych mechanizmów odpowiedzialnych za szybkość MGN i relaksacji.
W podsumowaniu należy zauważyć, iż podział starszych i młodszych badanych (w zależności od wartości maksymalnego gradientu narastania) na "wolnych" i "szybkich" wykazał, że wpływ wieku na szybkość narastania siły i relaksacji jest większy u osób z niskim MGN, w porównaniu z osobami z wysokim MGN. Różnice szybkości narastania siły pomiędzy grupami "wolnymi" a "szybkimi" występują głównie w pierwszej połowie narastania siły, a zanikają w końcowej fazie. Mogą one wynikać z odmiennego wzorca pobudzania różnych typów włókien, które decydują o wielkości rozwijanego napięcia oraz o szybkości jego narastania. Czynniki warunkujące przebieg narastania w końcowej fazie są prawdopodobnie niezależne od udziału włókien mięśniowych różnego typu.
W wyniku badań przeprowadzonych w tej serii stwierdzono, że maksymalna moc fosfagenowa obniża się z wiekiem, głównie w wyniku zmniejszania się prędkości ruchu. Ze względu na fakt, że maksymalna moc fosfagenowa (Pmax) jest iloczynem siły generowanej przez aktywne mięśnie oraz szybkości wykonywanych ruchów, udział obu tych składowych w rozwijanej mocy może być różny w poszczególnych mięśniach, wpływając na odmienną charakterystykę wydolności różnych osób. Jest ona uzależniona od cech samych mięśni, jak również od cech układu nerwowego, sterującego pracą określonych grup mięśniowych. Zmiany właściwości układu nerwowo-mięśniowego zachodzące z wiekiem nie są wystarczająco rozpoznane. Tylko nieliczne prace zostały poświęcone tej tematyce. Adach [1995] oraz Adach i wsp. [1999] do charakterystyki rozwijanej mocy wykorzystali test ergometryczny [Vandewalle i wsp., 1985]. Były również podejmowane próby opracowania charakterystyki różnych grup mięśniowych z wykorzystaniem pomiarów dynamometrycznych [Izqierdo i wsp., 1999].
Gdy porównuje się najmłodszą grupę (St-20) badanych z grupą najstarszą (S-60), to okazuje się, że zaobserwowany 17% (p<=0,01) spadek mocy (wyrażonej w W/kg) wynika głównie z obniżenia się składowej szybkościowej: V0 (p<=0,01). Druga składowa (F0) utrzymuje się w okresie badań na względnie stałym poziomie. Oznacza to, że obserwowany spadek mocy maksymalnej wynika wyłącznie z obniżania granicznej liczby obrotów. Tak więc systematyczny spadek V0 może potwierdzać spostrzeżenia Enoki [1994a], Kent-Braun i Alexandra [2000] oraz Younga i wsp. [1985] o znaczącym pogorszeniu koordynacji nerwowo-mięśniowej zachodzącej z wiekiem. Dotyczy to również tych czynności, które są wykonywane przy niewielkim oporze zewnętrznym. Jak wynika z uzyskanych wyników, zdolność do wykonywania ruchów wymagających rozwijania większego napięcia mięśniowego, ale z mniejszą szybkością, utrzymuje się do osiągnięcia starszego wieku.
Rozwijanie dużej mocy przez mięśnie może odgrywać istotniejszą rolę dla sprawnego funkcjonowania człowieka, zwłaszcza w starszym wieku, niż jego wysoka wydolność tlenowa lub siła [Bemben i wsp., 1996]. Warunkuje ono bowiem możliwość przeciwstawienia się siłom zewnętrznym, zapobiegania upadkom bądź ratowania się w nagłych, często niebezpiecznych sytuacjach. Wysoka wydolność fosfagenowa zależy nie tylko od wysokiego poziomu siły mięśniowej, ale również od sprawnej koordynacji nerwowo-mięśniowej. Uzyskane w trakcie niniejszych badań wyniki potwierdzają znany fakt stopniowego spadku poziomu rozwijanej mocy maksymalnej z wiekiem [Ecker, 1990; Feretti i wsp., 1994; Grassi i wsp., 1991]. Stwierdzona w najstarszej grupie mężczyzn Pmax, wyrażona w watach, jest mniejsza o około 30% od wyników grupy studentów i 40-letnich mężczyzn. Potwierdza to spostrzeżenia Brooks i Faulknera [1994], którzy stwierdzili, że moc mięśni różnych gatunków ssaków, w tym człowieka, zmniejsza się od pełnej dojrzałości do wieku starszego o około 30%. Uzyskane przez grupę M-40 wyniki wskazują, iż przy odpowiedniej aktywności ruchowej możliwe jest utrzymanie zdolności do osiągania wysokiej mocy do 50. roku życia, zwłaszcza że wysokie wartości mocy uzyskane przez mężczyzn z grupy St-20 (jako studentów wychowania fizycznego) mogą wynikać z ich wysokiej, codziennej aktywności fizycznej.
Z badań Grassi i wsp. [1991] wynika, że obniżanie wydolności fosfagenowej przebiega liniowo, w tempie 1% rocznie i do około 45. roku jest spowodowane pogarszaniem procesów sterowania nerwowo-mięśniowego. Uzyskany w niniejszej pracy spadek był więc nieco mniejszy i mógł wynikać z utrzymywania wysokiej aktywności ruchowej przez część badanych. Być może spostrzeżenia cytowanych autorów wynikały z zastosowanej metody (wyskoki obunóż na platformie), która stwarzała znacznie większe trudności wykonania osobom w starszym wieku, w porównaniu z próbą ergometryczną. Wyniki naszych badań wskazują jednocześnie, że ubytek mocy z wiekiem, przy jej wyrażeniu na kg masy ciała, jest zbliżony i wyniósł około 27%, a w relacji do beztłuszczowej masy ciała - około 20%. Pozwala to przypuszczać, że jest on spowodowany głównie systematycznym zmniejszaniem się masy aktywnych włókien mięśniowych (głównie FT). Z badań Rogersa i Evansa [1993] lub Bembena i wsp. [1996] wynika bowiem, że atrofia tkanki mięśniowej, a tym samym ubytek masy mięśniowej najintensywniej przebiega po 60. roku życia. Wprawdzie przeprowadzone w tej pracy badania nie miały charakteru badań ciągłych, jednak na podstawie uzyskanych wyników nie stwierdzono również "skokowego" obniżenia LBM oraz wyznaczanej mocy maksymalnej. Największe różnice w poziomie Pmax, które stwierdzono pomiędzy grupami M-40 i M-50, raczej nie wynikają ze zwiększonego zaniku tkanki mięśniowej, lecz z wysokiej wydolności fosfagenowej w grupie 40-latków. Są to wyniki porównywalne z uzyskiwanymi przez sportowców różnych dyscyplin sportowych (np. piłkarzy, rugbystów czy kolarzy) oraz studentów wychowania fizycznego [Jaskólska i wsp., 1990; Vandewalle i wsp., 1987].
Podkreśla się wprawdzie, że znaczący wpływ na poziom rozwijanej mocy może wywierać indywidualna aktywność fizyczna badanych, jednak z charakterystyki grup nie wynika, aby istniała zdecydowana różnica w jej poziomie u badanych trzech najmłodszych grup (St-20, M-40 i M-50). Zwłaszcza, że codzienna aktywność studentów była (z racji kierunku studiów) relatywnie wysoka. Możliwe więc jest, co podkreślają niektórzy autorzy [Mc Donagh i wsp., 1984; van Schaik i wsp., 1994; Doherty i wsp., 1993], że ewentualny ubytek aktywnej tkanki mięśniowej u badanych starszych grup jest częściowo kompensowany poprawą sprawności pobudzania nerwowo-mięśnio-wego.
Stopniowo obniżający się poziom mocy maksymalnej, rozwijanej w najstarszych grupach, wynika z naturalnie zmniejszonej zdolności do wykonywania przez osoby starsze cyklicznych ruchów z maksymalną intensywnością, wymagających współdziałania różnych grup mięśniowych [Kent-Brown i Alexander, 1999]. Jak wynika z badań Enoki [1994b] oraz Lewisa i Browna [1994], rozwijana moc jest uwarunkowana podobnymi czynnikami jak MVC odpowiednich mięśni, a jej poziom wraz z wiekiem spada nawet w większym od niej stopniu [Izqierdo i wsp., 1999]. Oprócz spadku masy mięś-niowej, na stopniowe obniżanie rozwijanej mocy mogą wywierać wpływ procesy pobudzania i relaksacji współdziałających mięśni antagonistycznych. Najwyższa intensywność wykonywanych wysiłków wymaga skutecznego pobudzania (jak największej liczby) jednostek szybko kurczących się, o wysokim progu pobudliwości [Feretti i wsp., 1994]. Jednocześnie istotną rolę odgrywa pozyskiwanie energii elastycznej, zgromadzonej w skurczonych mięśniach antagonistycznych [Grassi wsp., 1991]. Z badań Ting i wsp. [2000] wynika, że zarówno podczas chodzenia (biegu), jak i pedałowania ważną rolę odgrywają odruchy koordynujące pracę mięśni antagonistycznych obu pracujących kończyn. Ponieważ według Larssona [1978] z wiekiem dochodzi do zwiększonego spadku powierzchni włókien szybko kurczących się oraz zmniejszenia prędkości skurczu pojedynczych włókien mięśniowych, dlatego osoby starsze mogą rozwijać mniejszą maksymalną moc. Nakłada się na to zmniejszenie szybkości przewodzenia w nerwach [Enoka, 1994b] oraz aktywności enzymów związanych z uwalnianiem energii oraz zdolnością do utrzymania wysokiej mocy procesów resyntezy ATP z fosfokreatyny lub z ADP [Narici i wsp., 1991; Aniansson i wsp., 1981]. Zmiany przebiegu tych procesów uzasadniają spadkową tendencję uzyskanych w tej pracy wyników. Obserwuje się bowiem systematyczny spadek Pmax w starszych grupach badanych osób, także wyrażanej na kg masy ciała (ryc. 4.42, 4.43). Według Feretti i wsp. [1994], osiągana maksymalna moc odzwierciedla niższą sprawność układu mięśniowego, która w istotny sposób wpływa na wydolność beztlenową-fosfagenową.
Podsumowując uzyskane w tej części pracy wyniki, wykazano postępujący z wiekiem systematyczny spadek względnej mocy maksymalnej (wyrażonej na kg masy ciała), który wynika głównie ze znaczącego obniżenia składowej szybkościowej mocy (V0), przy jednoczesnym utrzymaniu na względnie stałym poziomie składowej siłowej mocy (F0).
U mężczyzn z wiekiem następuje znaczący spadek maksymalnej wartości siły, ale wielkość tego spadku zależy zarówno od długości mięśnia (uwarunkowanej kątem stawowym), od właściwości kurczliwych mięśni, ocenianych na podstawie maksymalnego gradientu narastania siły, jak i od charakteru pracy określonych grup mięśniowych. Stwierdzono bowiem, że spadek siły maksymalnej z wiekiem, podczas pracy w warunkach izometrycznych, był znacznie większy niż spadek siły (F0) przewidywanej z zależności między wielkością oporu a prędkością obrotów podczas testu ergometrycznego, wykonywanego kończynami dolnymi.
Spadek MVC z wiekiem w znacznym stopniu zależy od długości mięśni oraz od cech szybkościowo-siłowych. Najmniejszy spadek wystąpił przy wydłużonych mięśniach (w największym kącie stawowym), a największy przy mięśniach skróconych (w kącie mniejszym od optymalnego). Większy spadek maksymalnej siły mięśniowej wystąpił u osób starszych, charakteryzujących się niskimi wartościami maksymalnego gradientu narastania siły, przypuszczalnie posiadających zwiększoną odsetkową zawartość włókien ST w mięśniach.
Z wiekiem dochodzi do znaczącego spadku cech szybkościowych mięśni, niezależnie od angażowanych grup mięśniowych, jak też od rodzaju pracy. Podczas pracy w warunkach statyki, u osób starszych dochodzi do zmiany charakterystyki skurczu mięśni, związanej ze spadkiem szybkości skurczu i relaksacji. Największe różnice szybkości narastania siły wyrażonej w postaci gradientów (N/s) pomiędzy młodszymi a starszymi grupami stwierdzono w pierwszej połowie narastania, niezależnie od długości mięśni zginaczy stawu łokciowego.
Na obniżenie szybkości skurczu wpływają również cechy mięśni, gdyż w grupach osób o niskim MGN ("wolnych") wykazano z wiekiem większy spadek szybkości narastania siły do 50% MVC, wyrażony mniejszymi gradientami oraz wydłużonymi czasami odpowiednich faz. W drugiej połowie skurczu starsze grupy cechuje nieco większa wartość gradientów, a czas końcowej fazy narastania w tych grupach jest znacząco krótszy niż w grupach młodszych. Z wiekiem dochodzi również do spowolnienia wszystkich faz relaksacji oraz do wydłużenia czasu ich trwania, niezależnie od długości mięśni. Taka tendencja wyraźniej zaznacza się w grupach "wolnych".
Obniżanie się składowej szybkościowej mocy (V0), rejestrowane podczas próby ergometrycznej, jest również głównym powodem obniżania rozwijanej mocy (niezależnie od sposobu jego wyrażania), uwidocznionego w grupach osób, które przekroczyły 50. rok życia.
Adach Z. (1995) Evaluation of anaerobic power of the upper and lower body in middle-aged men using the force-velicity relationship. I. Congress of the European of Sports Medicine. 18-20 November, Brussels - Belgium. Abstracts Book, 3.
Adach Z., Jaskólska A., Jaskólski A. (1999) Wpływ wieku mężczyzn na moc beztlenową-fosfagenową i jej składowe podczas pracy kończynami dolnymi lub górnymi. "Wych. Fiz. i Sport", 2: 37-45.
Adach Z., Brzenczek W., Jaskólska A., Jaskólski A. (2000) Wpływ wieku na moc beztlenową i jej składowe u kobiet. "Wych. Fiz. i Sport", 2: 3-12.
Allen D.G., Lee J.A., Westerblad H. (1989) Intracellular calcium and tension during fatigue in isolated single muscle fibers from Xenopus Laevis. "J. Physiol.", 415: 433-458.
Aniansson A., Grimby G., Hedberg, Krotkiewski M. (1981) Muscle morphology, enzyme activity and muscle strength in elderly men and women. "Clin. Physiol.", 1: 73-86.
Aniansson A., Hedberg, Henning G.B., Grimby G. (1986) Muscle morpho-logy, enzymatic activity and muscle strength in elderly men: A follow-up study. "Muscle Nerve", 9: 585-591.
Ashley C.C., Lea T.J., Mulligan L.P., Palmer R.E., Simnett S.J. (1993) Activation and relaxation mechanisms in single muscle fibres. [In:]: Mechanism of myofilament sliding in muscle contraction. Eds: H. Sugi, G.H. Pollock. Plenum Press, New York, 97-115.
Baranyi M. (1967) ATPase activity of myosin correlated with speed of muscle shortening. "J. Gerontol. Physiol.", 50: 197-216.
Barański A. (2000) Przebieg relaksacji mięśni zginaczy w zależności od szybkości skurczu. Praca magisterska. Gorzów Wlkp. AWF.
Barclay C.J. (1992) Effect of fatigue on rate of isometric force development in mouse fast- and slow-twitch muscles. "Am. J. Physiol.", 263: C1065-C1072.
Barquin A., Lebacq J. (1992) Parvalbumin, labile heat and slowing of relaxation in mouse soleus and extensor digitorum longus muscles. "J. Physiol.", 445: 601-616.
Baumgarten T.A., Jackson T.S. (1987) Measurements for Evaluation in Physical Education and Exercise Science. WmC. Brown Dubuque Iowa, 92-97.
Bemben M.G., Clasey J.L., Massey B.H. (1990) The effect of the rate of contraction on the force-time curve parameters of male and female subjects. "Res. Q.", 61: 96-99.
Bemben M.G., Massey B.H., Bemben D.A., Boileau R.A., Misner R.J. (1995) Age-related patterns in body composition for men aged 20-79-yr. "Med. Sci. Sports Exerc.", 2: 264-269.
Bemben M.G., Massey B.H., Bemben D.A., Misner R.J., Boileau R.A. (1991) Isometric muscle force production as a function of age in healthy 20-74-yr old men. "Med. Sci. Sports Exerc.", 11: 1302-1310.
Bemben M.G., Massey B.H., Bemben D.A., Misner R.J., Boileau R.A. (1996) Isometric intermittent endurance of four muscle groups in men aged 20-74-yr. "Med. Sci. Sports Exerc.", 1: 144-154.
Booth F., Wedden S., Tseng B.S. (1994) Effect of aging on human skeletal muscle and motor function. "Acta Physiol. Scand.", 5: 556-560.
Borg J. (1981) Properties of single motor units of the extensor digitorum brevis in elderly humans. "Muscle & Nerve", 4: 429-434.
Borges O., Essen-Gustavsson B. (1989) Enzyme activities in type I and II muscle fibers of human skeletal muscle in relation to age and torque development. "Acta Physiol. Scand.", 136: 29-36.
Bosco C., Luhtanen P., Komi P.V. (1983) A simple Method for Measurement of mechanical power in jumping. "J. Appl. Physiol.", 50: 273-282.
Brooks S.V., Faulkner J.A. (1988) Contractile properties of skeletal muscles from young, adult and aged mice. "J. Physiol.", 404: 71-82.
Brooks S., Faulkner J.A. (1994) Skeletal muscle weakness in old age: underlying mechanisms. "Med. Sci. Sports Med." 26: 432-439.
Brown C.H., Wilmore J.H. (1972) A method for estimating the number of motor units in thenar muscles and the changes in unit count with aging. "J. Neurol. Neurosurg. Psychiatry", 35: 845-852.
Brown M., Hasser E. (1996) Complexity of age-related change in skeletal muscle. "J. Gerontol.", 51: B117-B123.
Bruce S.A., Newton D., Woledge R.C. (1989) Effect of age on voluntary force and cross-sectional area of human abductor pollicis muscle. "Quar. J. Exp. Physiol.", 74: 359-362.
Campbell M.J., McComas A.J., Petito F. (1973) Physiological changes in ageing muscles. "J. Neurosurg. Psychiatry", 36: 174-182.
Cannell M.B. (1986) Effect of tetanus duration on the free calcium during relaxation of frog skeletal muscle fibers. "J. Physiol." , 376: 203-218.
Celichowski J. (1998/99) Wpływ starzenia się organizmu na cechy i czynność jednostek motorycznych ruchowych. "Roczniki Naukowe" AWF Poznań, 47-48: 153-164.
Celichowski J. (1999) Zmiany cech jednostek ruchowych związane z procesem starzenia się organizmu a aktywność ruchowa. "Medycyna Sportowa", 98: 13 (streszczenia XXIV Zjazdu PTMS. Poznań, 22-25.IX.1999).
Claflin D.R., Faulkner J.A. (1985) Shorteningn velocity extrapolated to zeroload and unloaded shortening velocity of whole rat skeletal muscle. "J. Physiol.", 359: 357-363.
Clarkson P.M., Kroll W., Melchionda A.M. (1981) Age, isometric strength, rate of tension development and fiber type composition. "J. Gerontol.", 6: 648-653.
Cohn S.H., Vartsky D., Yasurura S., Savitsky A., Zanzi I., Vaswa-ni A., Ellis K.J. (1980) Compartmental body composition based on total body potassium, and calcium. "J. Physiol.", 239: 524-530.
Davies C.T., Thomas D.O., White M.J. (1986) Mechanical properties of young and elderly human muscle. "Acta Med. Scand.", Suppl. 711: 219-226.
Davies C.T., White M.J., Young K. (1983) Electrically-evoked and voluntary maximal isometric tension in relation to dynamic muscle performance in elderly male subjects, aged 69-yrs. "Eur. J. Appl. Physiol.", 51: 37-43.
Doherty T.J., Brown W.F. (1993) The estimated numbers and relative sizes of thenar motor units as selected by multiple point stimulation in young and older adults. "Muscle Nerve",16: 355-366.
Doherty T., Vandervoort A.A., Taylor A.W., Brown W.F. (1993) Effects of motor unit losses on strength in older men and women. "Can. J. Appl. Physiol.", 2: 868-874.
Duchateau J., Hainaut K. (1985) Electrical and mechanical failure during sustained and intermittent contractions in humans. "J. Appl. Physiol.", 58: 942-947.
Duchateau J., de Montigny L., Hainaut K. (1987) Electro-mechanical failures and lactate production during fatigue. "Eur. J. Appl. Physiol.", 56: 287-291.
Dulhunty A.F. (1990) The rate of tetanic relaxation is correlated with the density of calcium ATP-ase in the terminal cisternae of thyrotoxic skeletal muscle. "Pflügers Arch.", 415: 433-439.
Ecker K.R. (1990) Aerobic and anaerobic performance measures in active and inactive young and middle-aged males. Unpublished dr dissertation. University of Maryland.
Edman K.A. (1980) The role of non-uniform sarcomere behavior during relaxation of stria-ted muscle. "Eur. Heart J.",1, Suppl, A: 49-57.
Edman K.A., Flitney F.W. (1982) Laser diffraction studies of sarcomere dynamics during isometric relaxation in isolated muscle fibres of the frog. "J. Physiol.", 329: 1-20.
Edman K.A., Lou F. (1989) Changes in force and stiffness during fatigue of the frog isolated muscle fibers. "J. Physiol.", 415: 118P.
Edström L., Grimby L. (1986) Effect of exercise on the motor unit. "Muscle Nerve", 9: 104-126.
Edström L., Larsson L. (1987) Effect of age on contractile and enzyme-histochemical properties of fast- and slow-twitch single motor units in the rat. "J. Physiol." (London), 392: 129-145.
Edwards R.H., Hill D.K., Jones D.A. (1975) Metabolic changes associated with the slowing of relaxation in fatigued mouse muscle. "J. Physiol.", 251: 287-301.
Edwards R.H., Young A., Hosking G.P., Jones D.A. (1977) Human skeletal muscle function: description of tests and normal values. "Clin. Sci. Mol. Med.", 52: 283-290.
Enoka R.M. (1994a) Neuromechanical Basis of Kinesiology. 2nd ed. Human Kinetics, Champaign.
Enoka R.M. (1994b) Morphological Features and activation patterns of motor units. "J. Clin. Neurophysiol.", 12: 538-559.
Essén-Gustavsson R., Borges O. (1986) Histochemical and metabolic characteristics of human skeletal muscle in relation to age. "Acta Physiol. Scand.", 126: 107-114.
Ettema G.J., Huijing P.A. (1994) Skeletal muscle stiffness in static and dynamic contractions. "J. Biom.", 27: 1361-1368.
Evans W.J. (1986) Exercise and muscle metabolism in the elderly. Nutrition and Aging. Academic Press, Inc., New York, 179-191.
Falco F.J., Nennessey W.J., Braddom R.L., Goldberg G. (1992) Standarized nerve conduction studies in the upper limb of the healthy elderly. "Am. J. Phys. Med. Rehab.", 71: 263-271.
Feretti G., Narici M.V., Binzoni T., Gariod L., Le Bas J.F., Ceretelli P. (1994) Determination of peak muscle power: Effect of age and physical conditioning. "Eur. J. Appl. Physiol.", 68: 111-115.
Fitts R.H., Ba1og E.M. (1996) Effect of intracellular and extracellular ion changes on E-C coupling and skeletal muscle fatigue. "Acta Physiol. Scand.", 156: 169-181.
Fitts R.H., Courtright J.B., Kim D.H., Witzman F.A. (1982) Muscle fatigue with prolonged exercise: contractile and biochemical alterations. "Am. J. Physiol.", 242: C65-73.
Fleg J.L., Lakata E.G. (1988) Role of muscle loss in the age-associated reduction in VO2max. "J. Appl. Physiol.", 65: 1147-1151.
Florini J.R., Ewton D.Z. (1989) Skeletal muscle fiber types and myosin ATPase activity do not change with age or growth hormone administration. "J. Gerontol.", 44: B110-B117.
Freund H.J., Büdingen H.J., Dietz V. (1975) Activity of single motor unit from human forearm muscle during voluntary isometric contraction. "J. Neurophysiol.", 38: 933-946.
Frontera W.R., Hughes V.A., Lutz K.J., Evans W.J. (1991) A cross-sectional study of strength and mass in 45- to 78-yr-old men and women. "J. Appl. Physiol.", 71: 644-650.
Frontera W.R., Meredith C.N., O' Reilly K.P., Knuttgen H.G., Evans W.J. (1988) Strength conditioning in older men: skeletal muscle hypertrophy and improved function. "J. Appl. Physiol.", 64: 1038-1044.
Fryer M.W., Neering I.R. (1986) Relationship between intracellular calcium concentration and relaxation of rat fast and slow muscles. "Neurosc. Letters", 64: 231-235.
Gillis J.M. (1985) Relaxation of vertebrate skeletal muscle. A synthesis of the biochemical and physiological approaches. " Acta Biochim. Biophys.", 811: 97-145.
Goldman Y.E., Hibberd M.G., McCray J.A., Trentham D.R. (1982) Relaxation of muscle fibres by photolysis of caged ATP. "Nature", 300: 701-705.
Golnick P.D., Koerge P., Karpakka J., Saltin B. (1991) Elongation of skeletal muscle relaxation during exercise is linked to reduced calcium uptake by the sarcoplasmic reticulum in man. "Acta Physiol. Scand.", 142: 135-136.
Golnick P.D., Armstrong R.B., Saubert C.W., Piehl K., Saltin B. (1972) Enzyme activity and fiber composition in skeletal muscle of untrained and trained men. "J. Appl. Physiol.", 33: 312-319.
Gowitzke B.A., Milner M. (1988) Scientific bases of human movement. Williams & Wilkins, Baltimore, 157.
Grassi B., Ceretelli P., Narici M.V., Marconi C. (1991) Peak anaerobic power in master athletes. "Eur. J. Appl. Physiol.", 62: 394-399.
Grimby G., Saltin B. (1983) The ageing muscle. "Clin. Physiol.", 3: 209-218.
Gurfinkel V.S., Ivanenko Y.P., Levik Y.S. (1992) Some properties of linear relaxation in unfused tetanus of human muscle. "Physiol. Res.", 41: 437-443.
Häkkinen K., Pakarinen A. (1994) Serum hormones and strength development during strength training in middle-aged and elderly males and females. "Acta Physiol. Scand.", 150: 211-219.
Häkkinen K., Alen M., Komi P.V. (1984) Neuromuscular, anaerobic and aerobic performance characteristics of elite power athletes. "Eur. J. Appl. Physiol.", 53: 97-105.
Harries U.J., Bassey E.J. (1990) Torque-velocity relationships for the knee extensors in women in their 3 rd and 7th decades. "Eur. J. Appl. Physiol.", 60: 187-190.
Heizmann C.W., Berchtold M.W., Rowlerson A.M. (1982) Correlation of parvalbumin concentration with relaxation speed in mammalian muscles. "Proc. Natl. Acad. Sci.", 79: 7243-7247.
Henneman E. (1981) Recruitment of motoneurons: the size principle. [In:] Motor unit types, recruitment and plasticity in health and disaese. Ed. J.E. Desmedt. "Prog. Clin. Neurophysiol.", 28: 599-620.
Herzog W., Abrahamse S.K., ter Keurs H. E. (1990) Theoretical determination of force-length relations of intact human skeletal muscles using the cross-bridge model. "Pflügers Arch.", 416: 113-119.
Huijing P.A. (1998) Muscle, the motor of movement: properties in function, experiment and modelling. "J. Electromyography Kinesiol.", 8: 61-77.
Hunter S.K., Thompson M.W., Ruell P.A., Harmer A.R., Thom J.M., Gwinn T. H., Adams R.D. (1999) Human skeletal sarcoplasmatic reticulum Ca2+ uptake and muscle function with aging and strength training. "J. Appl. Physiol.", 86: 1859-1865.
Huxley A.F. (1957) Muscle structure and theories of contractions. "Prog. Biophys. Chem.", 7: 255-318.
Huxley A.F. (1980) Reflections on muscle. Princeton, New Yersey.
Huxley A.P., Simmons R.M. (1970) Rapid "give" and the tension "shoulder" in the relaxation of frog muscle fibres. "J. Physiol.", 210: P32.
Huxley A.F., Simmons R.M. (1972) Mechanical transients and the origin of muscular force. "Symp. Quant. Biol.", 37: 669-680.
Izqierdo M., Ibanez J., Gorostiaga E., Garrues M., Zuniga A., Anton A., Larrion J.L., Häkkinen K. (1999) Maximal strength and power characteristics in isometric and dynamic actions of the upper and lower extremities in middle-aged and older men. "Acta Physiol. Scand.", 167: 57-68.
Jackson A.S., Beard E.F., Wier L.T., Ross R.M., Stuteville J.E., Blair S.N. (1995) Changes in aerobic power of men, ages 25-70-yr. "Med. Sci. Sports Exerc.", 1: 113-120.
Jaskólska A. (1998) Przebieg zmian narastania siły i relaksacji u ludzi po wysiłkach o różnej charakterystyce. Monografia Nr 326, AWF Poznań.
Jaskólska A., Kisiel K., Adach Z., Jaskólski A. (1999a) Szybkość narastania siły mięśniowej a kąt optymalny w stawie łokciowym. "Wych. Fiz. i Sport", 3: 78-93.
Jaskólska A., Kisiel K., Adach Z., Jaskólska A. (1999b) Szybkość relaksacji a kąt optymalny w stawie łokciowym. "Wych. Fiz. i Sport", 3: 95-110.
Jaskólska A., Jędrzejewska K., Jaskólski A. (1990) Zależność siła-prędkość i wielkość mocy beztlenowej podczas pracy kończynami dolnymi i górnymi. "Wych. Fiz. i Sport", 1: 51-59.
Jaskólski A., Kisiel K., Adach Z., Jaskólska A. (1999) Speed of force development during maximal voluntary contraction change with elbow joint angle. XXI Congress of the Polish Physiological Society, Poznań (streszczenia).
Jaskólski A., Kisiel K., Adach Z., Jaskólska A. (2000) The influence of elbow joint angle on different phases of force development during maximal voluntary contraction. "Can. J. Appl. Physiol.", 6: 453-465.
Jones D.A. (1981) Muscle fatigue due to changes beyond neuromuscular junction. [In:] Human muscle fatigue: physiological mechanism. Eds. R.Porter, J.Whelan. Ciba Foundation Symposium 82. Pitman Medical, London, 178-196.
Kanda K., Hashizume K. (1989) Changes in properties of the medial gastrocnemius motor units in aging. "J. Neurophysiol.", 61: 737-746.
Kent-Brown J.A., Alexander V.N. (1999) Specific strength and voluntary muscle activation in young and elderly women and men. "J. Appl. Physiol.", 87: 22-29.
Kent-Brown J.A., Alexander V.N., Young K. (2000) Skeletal muscle contractile and noncontractile components in young and older women and men. "J. Appl. Physiol.", 88: 662-668.
Kędzior K., Kotwicki E., Niwiński W. (1987) Testing module for static and dynamic measurements of muscle group characteristic. [In:] Ed. B. Johnson. Biomechanics XB, Human Kinetics, Champaign, 1127-1130.
Klitgaard H., Mantoni M., Schiaffino S. (1990) Function, morphology and protein expression of ageing skeletal muscle: a cross-sectional study of elderly men with different training backgrounds. "Acta Physiol. Scand.", 140: 41-54.
Kozłowski S., Nazar K., Kociuba-Uściłko H. (1995) Fizjologia wysiłków fizycznych. [W:] S. Kozłowski, K. Nazar: Wprowadzenie do fizjologii klinicznej. PZWL, Warszawa, 152-153.
Kroll W., Clarkson P.M. (1978) Age, isometric knee extension strength and fractionated resisted response time. "Experimental Aging Research", 4: 389-409.
Kukulka C.G., Clamann H.P. (1981) Comparison of the recruitment and discharge properties of motor units in human brachial biceps and adductor pollicis during isometric contractions. "Brain Res.", 219: 45-55.
Laframboise J., Cafarelli E. (1994) Differential effects of voluntary and involuntary activation on contractile characteristics of two human muscle. "J. Appl. Physiol.", 3: 1400-1402.
Larsson L. (1978) Morphological and functional characteristics of the ageing skeletal muscle in man. "Acta. Physiol. Scand.", Suppl. 457: 1-36.
Larsson L., Ansved T. (1988) Effect of age on the motor units in the rat. Central Determinants of Age-Related Declines in Motor Function. Ed. J. A. Joseph. "Ann. N. Y. Acad. Sci.". The New York Academy of Sciences, New York, 163: S27-S-29.
Larsson L., Edström L. (1986) Effect of age on enzyme-histochemical fibre spectra and contractile properties of fast- and slow-twitch skeletal muscle in the rat. "J. Neurol. Sci.", 76: 69-89.
Larsson L., Karlsson J. (1978) Isometric and dynamic endurance as a function of age and skeletal muscle characteristics. "Acta Physiol. Scand.", 104: 129-136.
Larsson L., Salviatti G. (1989) Effects of age on calcium transport activity of sarcoplasmatic reticulum in fast- and slow-twitch rat muscle fibres. "J. Physiol.", 419: 253-264.
Larsson L., Grimby G., Karlsson J. (1979) Muscle strength and speed movement in relation to age and muscle morphology. "J. Appl. Physiol.", 46: 451-456.
Larsson L., Ansved T., Edström L., Gorza L., Schiaffino S. (1991) Effect of age on physiological, immunochemical and biochemical properties of fast-twitch single motor units in the rat. "J. Physiol.", 443: 257-275.
Lewis R.D., Brown J.M. (1994) Influence of muscle activation dynamics on reaction time in the elderly. "Eur. J. Appl. Physiol.", 69: 344-349.
Lexell J. (1993) Ageing and human muscle: Observations from Sweden. "Can. J. Appl.",1: 2-18.
Lexell J., Downham D., Sjöström M. (1986) Distribution of different fibre types in human skeletal muscle: fibre type arrangement in m. vastus lateralis from three groups of healthy men between 15 and 83 years. "J. Neur. Sci.", 72: 211-222.
Lexell J., Henriksson-Larssen K., Sjöström M. (1983) Distribution of different fibre types in human skeletal muscle. 2. A study of cross-sections of whole m. vastus lateralis. "Acta Physiol. Scand.", 117:115-1222.
Lexell J., Taylor C., Sjöström M. (1988) What is the cause of the ageing atrophy? Total number, size and proportion of different fibre types studied whole vastus lateralis muscle from 15- to 83-year old men. "J. Neur. Sci.", 84: 275-294.
Lexell J., Hendriksson-Larssen K., Winblad B., Sjöström M. (1983) Distribution of different fibre types in human skeletal muscles: effects of aging studied in whole muscle cross-section. "Muscle Nerve", 6: 588-595.
Margreth A., Damiani E., Bortoloso E. (1999) Sarcoplasmatic reticulum in aged skeletal muscle. "Acta Physiol. Scand.", 167: 331-338.
Marsh E., Sale D., McComas A.J., Quinlan J. (1981) Influence of joint position of ankle dorsiflexion in humans. "J. Appl. Physiol." (Resp. Environ. Exerc. Physiol.), 51: 160-167.
Mazzeo R.S., Cavanagh P., Evans W.J., Fiatarone M., Hagberg J., Mc Auley E., Startzell J. (1998) ACSM Position Stand on Exercise and physical activity for older adults. "Med. Sci. Sports Med.", 6: 992-1008.
McComas A.J., Sica R.E., Campbell M.J., Upton A.R. (1971) Functional compensation in partially denervated muscles. "J. Neurol. Neurosurg. Psychiatry", 34: 453-460.
McDonagh M.J., Newton J.P., Yemm R. (1987) Age changes in motor unit threshold firing rate in the first dorsal interosseous muscle in man. "J. Physiol.", 392: 104P.
McDonagh M.J., White M.J., Davies C.T. (1984) Different effects of aging on the mechanical properties of arm and leg muscles. "Gerontology", 30: 49-54.
Meredith C.N., Frontera W.R., Fisher E., Hughes V., Herland J., Edwards J., Evans W.J. (1989) Peripheral effects of endurance training in young and old subjects. "J. Appl. Physiol.", 66: 2844-2849.
Mero A., Luhtanen P., Viitasalo J.T., Komi P.V. (1981) Relationship between the maximal running velocity, muscle fiber characteristics, force production and force relaxation of sprinters. "Scand. J. Sports Sci.", 3: 16-22.
Metzger J.M., Moss R.L. (1990) Calcium-sensitive cross-bridge transitions in mammalian fast and slow skeletal muscle fibers. "Science", 247: 1088-1090.
Mianowski K. (1996) Stanowisko do badań biomechanicznych. "Zeszyty Naukowe", AWF Wrocław.
Milner-Brown H.S., Stein R.B. (1973) Changes in firing rate of motor units during linearly changing voluntary contractions. "J. Physiol.", 230: 371-390.
Morris A.F., Clarke D.H., Dainis A. (1983) Time to maximal voluntary isometric contraction (MVC) for five different muscle groups in college adults. "Res. Quart.", 54:163-168.
Murray M.P., Gardner G.M., Mollinger L.A., Sepic S.B. (1980) Strength of isometric and isokinetic contractions. "Physical Therapy", 4: 412-419.
Müntener M., Kaser L., Weber J., Berchtold M.W. (1995) Increase of skeletal muscle relaxation speed by direct injection of parvalbumin cDNA. "Proc. Nat. Acad. Sci. USA", 92: 6504-6508.
Naczk M. (2000) Zróżnicowanie parametrów okresu narastania siły w zależności od wielkości maksymalnego gradientu narastania siły. Praca magistarska. AWF Gorzów Wlkp.
Nakazawa K., Kawakami Y., Fukunaga T., Yano H., Miyashita M. (1993) Differencies in activation patterns in elbow flexor muscles during isometric, concentric and eccentric contractions. "Europ. J. Appl. Physiol.", 66: 214-220.
Narici M.V., Bordini M., Ceretelli P. (1991) Effect of ageing on human adductor pollicis muscle function. "J. Appl. Physiol.", 71: 1277-1281.
Newton J.P., Yemm R., McDonagh M.N. (1988) Study of age changes in the motor units of the first dorsal interosseous muscle in man. "Gerontology", 34: 115-119.
Nygaard E., Sanchez J. (1982) Intramuscular variation of fiber type in the brachial biceps and the lateral vastus muscles of elderly men: how representative is a small sample? "Anat. Rec.", 3: 451-459.
Oishi K., Nigorikawa T. (1988) Time to peak force and force developing speed during fast maximal and submaximal isometric voluntary contractions. "Ann. Physiol. Anthrop.", 7: 5-14.
Pagala M.K. (1980) Effect of length and coffeine on isometric tetanus relaxation of frog sartorius muscles. "Biochem. Biophys. Acta", 594: 177-180.
Parker T.E. (1978) Wprowadzenie do statystyki dla biologów. PWN, Warszawa, 98-107.
Petrigrew F.P., Noble E.G. (1991) Shifts in rat plantaris motor unit characteristics with aging and compensatory overload. "J. Appl. Physiol.", 71: 2363-2368.
Piazzesi G., Linari M., Reconditi M., Vanzi F., Lombardi V. (1997) Cross-bridge detachment and attachment following a step stretch imposed on active single frog muscle fibres. "J. Physiol.", 498: 3-15.
Pollack G.H. (1990) Muscles & Molecules. Uncovering the principles of biological motion. Ebner & Sons Publishers, 141-142.
Porter M.M., Myint A., Kramer J.F., Vandervoort A.A. (1995) Concentric and eccentric knee extension strength in older and younger men and women. "Can. J. Physiol.", 4: 429-439.
Proske U., Morgan D.L. (1984) Stiffness of cat soleus muscle and tendon during activation of part of muscle. "J. Neurophysiol.", 52: 459-468.
Rack P.M., Westbury D.R. (1972) The short range stiffness of active mammalian muscle. "J. Physiol.", 229: 16-17P.
Rasch P.J. (1995) Effect of position of forearm strength of elbow flexion. "Res. Q.", 27: 333-337.
Rassier D.E., McIntosh B.R., Herzog W. (1999) Length dependence of active force production in skeletal muscle. "J. Appl. Physiol.", 86: 1445-1457.
Reiser P.J., Moss R.L., Giulian G.G., Greaser M.L. (1985) Shortening velocity and myosin heavy chains of developing rabbit muscle fibers. "J. Biol. Chem.", 27: 14403-14405.
Robinson S.D., Dill D.B., Tzankoff. SP., Wagner J.A., Robin- son R.D. (1975) Longitudinal studies of aging in 37 men. "J. Appl. Physiol.", 38: 263-267.
Rogers M.A., Evans W.J. (1993) Changes in skeletal muscle with aging: Effects of exercise training. "Exerc. Sport Sci. Rev.", 20: 64-102. Ed. J. Holloszy. Wiliams & Wilkins. Baltimore.
Round J.M., Jones D.A., Chapman S.J., Edwards R.H.T., Ward P.S., Fodden D.L. (1984) The anatomy and fibre type composition of the human adductor pollicis in relation to its contractile properties. "J. Neurol. Sci.", 66: 263-292.
Sato T., Akatsuka H., Kuniyoshi K., Tokoro Y. (1984) Age changes in size and number of muscle fibers in human minor pectoral muscle. "Mech. Ageing Dev.", 28: 99-109.
Schaumburg H.H., Spencer P.S., Ochoa J. (1983) The aging human peripheral nervous system. [In:] Eds. R. Katzman, R.Terry. "The Neurology of Aging", 111-122.
Shepard R.J. (1997) Ageing, Physical Activity and Health. Human Kinetics, Champaign.
Sica R. E. P., McComas A. J. (1971) Fast and slow twitch units in a human muscle. "J. Neurol. Neurosurg. Psychiatry", 34: 113-120.
Simmons R.M., Jevell B.R. (1974) Mechanism and models of muscular contractions. "Recent Adv. Physiol.", 9: 87-147.
Singh M., Karpovich P.V. (1966) Isotonic and isometric forces of forearm flexors and extensors. "J. Appl. Physiol.", 21: 1435-1437.
Szczęsna D., Guzman G., Miller T., Zhao J., Farokhi K., Ellemberger H., Potter J.D. (1996) The role of the four Ca2+ binding sites of troponin C in the regulation of skeletal muscle contraction. "J. Biol. Chem.", 271: 8381-8386.
Taylor A.W., Noble E.G., Cunningham D.A., Pnierson D.H., Rechnilzer P. (1992) Ageing, skeletal muscle contractile properties and enzyme activities with exercise. [In:] Eds. Y. Sato, J. Poonmans, I. Hashimoto and Y. Oshida. "Med. and Sport Sci.", 37: 109-125.
Thompson L.V., Brown M. (1999) Age-related changes in contractile properties of single skeletal fibers from the soleus muscle. "J. Appl. Physiol.", 83: 881-866.
Ting L.H., Kautz S.A., Brown D.A., Zajac F.E. (2000) Contralateral movement and extensor force generation alter flexion phase muscle coordination in pedalling. "J. Neurophysiol.", 83: 3351-3365.
Tomlinson B.E., Irving D. (1977) The numbers of limb motoneurons in the human lumbosacral cord throughout life. "J. Neurol. Sci.", 34: 213-218.
Vandervoort A.A., Hayes K.C. (1989) Plantarflexor muscle function in young and elderly women. "Eur. J. Appl. Physiol.", 58: 389-394.
Vandervoort A.A., Mc Comas J. (1986) Contractile changes in opposing muscles of the human ankle and joint with aging. "J. Appl. Physiol.",1: 361-367.
Vandewalle H., Peres G., Heller J., Monod H. (1985) All-out anaerobic capacity test on cycle ergometer. A comparative study on men and women. "Eur. J. Appl. Physiol.", 54: 222-229.
Vandewalle H., Peres G., Heller J., Panel J., Monod H. (1987) Force-velocity relationship and maximal power on a cycle ergometer. "J. Appl. Physiol.", 56: 650-656.
Van Schaik C.S., Hicks H. L., McCartney N. (1994) An evaluation of the length-tension relationship in elderly human ankle dorsiflexors. "J. Gerontol.", 3: B121-127.
Viitasalo J.T., Komi P.V. (1981a) Effects of fatigue on isometric force-and relaxation-time characteristics in human muscle. "Acta Physiol. Scand.", 11: 87-95.
Viitasalo J.T., Komi P.V. (1981b) Interrelationships between electromyographic, mechanical, muscle structure and reflex time measurements in man. "Acta Physiol. Scand.", 111: 97-103.
Wahr P.A. (1994) Determinants of the kinetics of force development and relaxation in skeletal muscle. Dr dissertation. The Ohio State University.
Wallingade Jonge W., Boom H.B., Boom K.L. (1980) Force development of fast and slow skeletal muscle at different muscle lengths. "Am. J. Physiol.", 239: 98-104.
Westerblad H., Lannergren J. (1991) Slowing of relaxation during fatigue in single mouse muscle fibers. "J. Physiol.", 434: 323-336.
Winter E.M. (1994) Maximal intensity exercise. Kinantropometry and exercise physiology laboratory manual. Tests, procedures, data. Eds. R. Eston, T. Reilly. SPON, New York.
Winter E.M., Brookes F.B., Hamley E.J. (1987) A comparison optimised and non-optimised peak power output in young active men and women. "J. Sports Sci.", 5: 71-82.
Young A., Stokes M., Crowe M. (1985) The size and strength of the quadriceps muscles of old and young men. "Clin. Physiol.", 5: 145-154.
It is well documented that there is a decrease in physical fitness and a limitation of performing a common daily activities with human age. Beside a decrease of muscle strength there is a slowing of muscle speed and relaxation. Maximal power is also reduced.Causes of age related changes are insufficiently recognized and explained. Involutions processes begin from early adult age but initially they are very slow and almost imperceptible. Later (especially in 7th decade of life) they strongly escalate.
To evaluate the influence of age on muscle physiological and mechanical properties, men aged 20-76 years were tested. Tests were performed in static and dynamic conditions. Influence of age on force development and relaxation of elbow flexor muscles during maximal voluntary contraction (MVC) and anaerobic peak power of lower extremities during cycle ergometer test were measured.
Three separate experiments (I, II, III) were conducted. The aim of the experiment I was to determine the influence of age on the relations between elbow joint angle and force development and relaxation.
The purpose of the experiment II was to test the influence of age on a dependence of force development and relaxation on contractile properties of elbow flexor muscles.
The aim of the experiment III was to assess the effect of age on anaerobic-phosphagenic power measured during a cycle ergometer test.
The experiment I was conducted on 63 men aged 40 to 76 yrs. The subjects were divided into 4 age groups: St-20: 15 men aged 20 to 25 yrs; M-40: 16 men aged 34 to 50 yrs; 16 men aged 51 to 60 yrs; S-60: 16 men aged over 60 yrs. Seventy six men participated in the experiment II. The subjects were divided into 2 age groups: younger (Mł), numbers 46, aged 21 to 24 yrs, and older (St) numbers 30, aged 51 to 76 yrs. Among subjects of younger and older groups, subjects with a high ("fast"; Sz) and low values of maximal rate of force development (MGN) ("slow"; W) were separated. The young "fast" (Sz-Mł) and "slow" (W-Mł) groups consisted of 14 men. The old "fast" (Sz-St) and "slow" (W-St) groups consisted of 10 men. In experiment III, 62 men (divided into 4 age groups) took part: 25 students (St-20) aged 20 to 24 yrs; 14 men aged 39 to 49 yrs (M-40); 15 men aged 51 to 56 yrs (M-50), and 8 men aged 61-69 yrs (S-60).
The measurement of elbow flexor muscles (the arm and forearm were held in a horizontal plane) was performed on a "Biodyna" dynamometer. Measurements of force-time characteristic were carried out in 3 joint angles (60°, 90° and 120°), during 2 testing sessions. Each session consisted of 4 trials of maximal isometric contractions (MVC) at each angle. After hearing a first signal, subject was instructed to develop a maximal tension of the elbow flexor muscles as rapidly as possible and relax as fast as possible after the next signal. From analysis of force-time curve (F-t), the values of MVC, MGN, and the rates and times of the each early (GWN and tWN), half (G50%N and PtN), late (GPN and tPN) and most late (GKN and tKN) force development were established. The respective rates and times of relaxation were also measured: (GWR and tWR), half (G50%R and PtR), late (GPR and tPR) and most late (GKR and tKR).
A Vandewalle's method was used to estimate anaerobic-phosphagenic power. Peak power (Pmax) was calculated as a Pmax =0,5V0 x 0,5F0, where V0 was a pedaling rate at a braking force of 0N, and F0 was a braking force on the flywheel at a velocity of 0m/s.
The results were statistically analyzed. A one-way analysis of variance (ANOVA) was used to determine significance differences between age groups for each parameter (p(0,01 or p(0,05). A multiple analysis of variance (MANOVA) for repeated measures was used, to compare data obtained at a different joint angles and between the groups. When MANOVA revealed a statistical significance, a post-hoc contrast test was used to estimate significance level for consecutive joint angles (p(0,01 or p(0,05).
The results indicate that the changes in muscles themselvesand in nerve-muscle coordination occurring with age, lead to a significant decline in maximal voluntary contraction (MVC) performed at a different joint angle, especially in the subjects over 50th years of age. Compared to the optimal angle (Lo), the decrease of MVC at a joint angle of 60° was bigger than the decrease at 120°. Independent of age, significant differences of early and half force development were found between the optimal angle (90º) and other joint angles (60º and 120º), with a bigger differences recorded between 90º and 60° than between 90º and 120°. The results indicate a different influence of elbow joint angle on muscle contraction characteristic in young men compared to old men. Moreover, there was a tendency toward a time elongation of early, half and late force development phase in older men (in all joint angles). In contrast, there was a significant shortening of most late force development time (tKN) and a time to achieve MVC (tMVC). The duration time of each phase and tMVC were independent on joint angle.
The course of relaxation phase also showed age-related differences. Significantly smaller rates and bigger times of values of first half relaxations phase (GWR and G50%R) were found in the oldest group compared to the young. On the other hand, a value of most late relaxation rate (GKR) was bigger in the oldest group compared to the youngest.
When old and young subjects were divided in respect to MGN value into the "slow" and "fast" groups, the influence of age on force development and relaxation rates of each phases was greater in "slow" group (i.e. with lower MGN, probably with bigger percentage content of ST fibers in muscles) than in "fast" group.
Especially, the rates of force development from 5% to 50% MVC decreased much more with age in "slow" group, compared to the "fast" group, while a differences of late and most late phase were much smaller. There was also found a bigger decrease of relaxation speed with an age in the "slow" groups than in young because of elongation of time of all relaxation phases.
The results showed a gradual decrease of relative peak-power (calculated on kg body mass) with age, as a result of a significant decrease of peak-power (V0). Force component (F0) was found to be less dependent on age. It stays on comparable stable level till old age.